Clathrin-vermittelte Endozytose
Die Clathrin-vermittelte Endozytose bezeichnet die Aufnahme von Molekülen in eukaryotische Zellen über Clathrin-beschichtete Vesikel. Sie ist der häufigste der vier Mechanismen der Endozytose. Diese Form zählt auch als rezeptorvermittelte Endozytose.
Eigenschaften
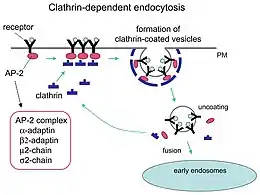
Bei der Clathrin-vermittelten Endozytose wird ein Bereich der Zellmembran durch Einstülpung und Abschnürung zu Vesikeln innerhalb der Zelle. Dieser Mechanismus ist der hauptsächliche Mechanismus der Endozytose in den meisten Zellen.[1][2] Daran sind über 50 Proteine beteiligt.[3][4] Die Einstülpung wird nach einer Bindung eines Liganden an seinen Rezeptor durch das Protein Clathrin auf der Innenseite der Zellmembran gefördert.[5] Clathrin befindet sich in bestimmten Bereichen der Zellmembran, den Clathrin-coated pits (clathrinbeschichtete Vertiefungen). Nach Abschnürung besitzen die Clathrin-coated Vesicles (clathrinbeschichtete Vesikel) einen Durchmesser von circa 100 nm. Die Abschnürung erfolgt durch Bildung eines Rings aus Dynaminen.[6] Verschiedene Proteine werden nach einer Bindung an einen Rezeptor auf der Zellmembran über Clathrin-Vesikel in die Zelle geschleust, z. B. LDL, Transferrin, Wachstumsfaktoren und Antikörper. Die entsprechenden Rezeptoren sind der LDL-Rezeptor, der Transferrinrezeptor, der EGF-Rezeptor und der Fc-Rezeptor.
Zellen regulieren die Rezeptordichte auf der Zellmembran und damit die Signalintensität der Rezeptoren bei Aktivierung durch Endozytose von Rezeptoren, wodurch sie mehr oder weniger lange für die Bindung eines Liganden zur Verfügung stehen.[7][8][9] Durch die Clathrin-vermittelte Endozytose kann die Signaltransduktion an der Zellmembran unterbrochen werden.[10]
Manche Rezeptoren werden mit, andere ohne gebundenen Liganden endozytiert. Teilweise erfolgt bei Rezeptoren mit gebundenem Liganden eine Signaltransduktion des Rezeptors auch noch vom Vesikel aus.[11] Nach der Bindung des Rezeptors an ein Adapter- und Sortierungsprotein wie numb oder disabled in der Vertiefung werden weitere Proteine wie AP-2 und EHD-Proteine gebunden.[11] Zu Beginn der Endozytose wird beim Aufbau der Vertiefung der sekundäre Botenstoff PI(4,5)P2 gebildet, während er im weiteren Verlauf der Reifung der Vertiefung abgebaut wird und stattdessen PI(3,4)P2 gebildet wird.[12] Der Transport der Vesikel erfolgt entlang des Aktin-Zytoskeletts.[3][13]
Die Clathrin-vermittelte Endozytose lässt sich in acht Phasen einteilen:[3] Festlegung des Ortes, Rekrutierung von Clathrin und Adapterproteinen, Einbeulung der Zellmembran, Vertiefung, Beginn des Einschlusses durch Einwärtsbewegung der Vertiefung, Abschnürung des Vesikels, Bewegung des Vesikels entlang des Zytoskeletts, Recycling der Proteine im Vesikel und Fusion mit einem Endosomen.
Einige Viren verwenden die Clathrin-vermittelte Endozytose, um in Zellen zu gelangen, wie z. B. das Hämagglutinin des Influenzavirus, das VSV-G des vesicular stomatitis virus und das Adenovirus, während andere Viren direkt die Zellmembran durchdringen.[14][15]
Einzelnachweise
- V. Bitsikas, I. R. Corrêa, B. J. Nichols: Clathrin-independent pathways do not contribute significantly to endocytic flux. In: eLife. Band 3, 2014, S. e03970, doi:10.7554/eLife.03970, PMID 25232658, PMC 4185422 (freier Volltext).
- T. Kirchhausen, D. Owen, S. C. Harrison: Molecular Structure, Function, and Dynamics of Clathrin-Mediated Membrane Traffic. In: Cold Spring Harbor Perspectives in Biology. 6, 2014, S. a016725, doi:10.1101/cshperspect.a016725.
- B. L. Goode, J. A. Eskin, B. Wendland: Actin and endocytosis in budding yeast. In: Genetics. Band 199, Nummer 2, Februar 2015, S. 315–358, doi:10.1534/genetics.112.145540, PMID 25657349, PMC 4317646 (freier Volltext).
- C. J. Merrifield, M. Kaksonen: Endocytic accessory factors and regulation of clathrin-mediated endocytosis. In: Cold Spring Harbor perspectives in biology. Band 6, Nummer 11, November 2014, S. a016733, doi:10.1101/cshperspect.a016733, PMID 25280766.
- Alexander Sorkin, Manojkumar A. Puthenveedu: Yosef Yarden (Hrsg.): Clathrin-Mediated Endocytosis (en). Springer New York, 1. Januar 2013, ISBN 978-1-4614-6527-0, S. 1–31, doi:10.1007/978-1-4614-6528-7_1.
- A. C. Sundborger, J. E. Hinshaw: Regulating dynamin dynamics during endocytosis. In: F1000prime reports. Band 6, 2014, S. 85, doi:10.12703/P6-85, PMID 25374663, PMC 4191240 (freier Volltext).
- P. P. Di Fiore, M. von Zastrow: Endocytosis, signaling, and beyond. In: Cold Spring Harbor perspectives in biology. Band 6, Nummer 8, August 2014, S. , doi:10.1101/cshperspect.a016865, PMID 25085911.
- R. Irannejad, N. G. Tsvetanova, B. T. Lobingier, M. von Zastrow: Effects of endocytosis on receptor-mediated signaling. In: Current opinion in cell biology. Band 35, August 2015, S. 137–143, doi:10.1016/j.ceb.2015.05.005, PMID 26057614, PMC 4529812 (freier Volltext).
- Thomsen AR, Plouffe B, Cahill TJ, Shukla AK, Tarrasch JT, Dosey AM, Kahsai AW, Strachan RT, Pani B, Mahoney JP, Huang L, Breton B, Heydenreich FM, Sunahara RK, Skiniotis G, Bouvier M, Lefkowitz RJ: GPCR-G Protein-β-Arrestin Super-Complex Mediates Sustained G Protein Signaling. In: Cell. 166, 2016, S. 907–19. doi:10.1016/j.cell.2016.07.004. PMID 27499021.
- Boris N. Kholodenko: Four-Dimensional Organisation of Protein Kinase Signaling Cascades: the Roles of Diffusion, Endocytosis and Molecular Motors. In: J. Exp. Biol.. 206, Nr. Pt 12, 2003, S. 2073–82. 206, 2073-2082. doi:10.1242/jeb.00298. PMID 12756289.
- C. C. Yap, B. Winckler: Adapting for endocytosis: roles for endocytic sorting adaptors in directing neural development. In: Frontiers in cellular neuroscience. Band 9, 2015, S. 119, doi:10.3389/fncel.2015.00119, PMID 25904845, PMC 4389405 (freier Volltext) (Review).
- Y. Posor, M. Eichhorn-Grünig, V. Haucke: Phosphoinositides in endocytosis. In: Biochimica et Biophysica Acta. Band 1851, Nummer 6, Juni 2015, S. 794–804, doi:10.1016/j.bbalip.2014.09.014, PMID 25264171.
- E. S. Kornilova: Receptor-mediated endocytosis and cytoskeleton. In: Biochemistry. Biokhimii?a?. Band 79, Nummer 9, September 2014, S. 865–878, doi:10.1134/S0006297914090041, PMID 25385015.
- S. Boulant, M. Stanifer, P. Y. Lozach: Dynamics of virus-receptor interactions in virus binding, signaling, and endocytosis. In: Viruses. Band 7, Nummer 6, Juni 2015, S. 2794–2815, doi:10.3390/v7062747, PMID 26043381, PMC 4488714 (freier Volltext).
- P. Cossart, A. Helenius: Endocytosis of viruses and bacteria. In: Cold Spring Harbor perspectives in biology. Band 6, Nummer 8, August 2014, S. , doi:10.1101/cshperspect.a016972, PMID 25085912.