Lumasiran
Lumasiran ist ein Arzneistoff, der als Oxlumo (Hersteller Alnylam Pharmaceuticals) zur Behandlung der primären Hyperoxalurie vom Typ 1 (PH1) zugelassen wurde, einer seltenen Erbkrankheit, bei der es zu einer extrem hohen Oxalatausscheidung kommt.[2][3][4] Es ist ein weiterer Vertreter einer vergleichsweise neuen Wirkstoffklasse, deren Wirkung auf RNA-Interferenz (RNAi) beziehungsweise RNA-Silencing (Gen-Stilllegung) beruht. In den Biowissenschaften hat sich RNA-Interferenz als eine Möglichkeit zur vorübergehenden Stilllegung von Genen („Gen-Knockdown“) etabliert. Man spricht bei dieser Substanzklasse von RNAi-Therapeutika.
| Nukleinsäure | |
|---|---|
 | |
| Nukleoside: A = Adenosin, C = Cytidin, G = Guanosin, U = Uridin | |
| Allgemeines | |
| Freiname | Lumasiran[1] |
| Andere Namen |
|
| Identifikatoren | |
| CAS-Nummer |
1834610-13-7 |
| Wirkstoffdaten | |
| DrugBank | |
| ATC-Code |
A16AX18 |
| Wirkmechanismus | |
| Eigenschaften | |
| Größe |
C530H712F10N173O320P43S6 |
| Struktur |
Synthetisches doppelsträngiges siRNA-Oligonukleotid, kovalent verknüpft mit einer verzweigten GalNAc-Verbindung (L96) |
Lumasiran ist eine doppelsträngige, kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA), die als Konjugat mit einer verzweigten GalNAc-Verbindung vorliegt. Zur Behandlung der PH1 hat das Mittel einen Orphan-Drug-Status,[5] das heißt, es ist ein Arzneimittel gegen eine seltene Krankheit.
Anwendungsgebiete
Lumasiran ist angezeigt zur Behandlung der primären Hyperoxalurie vom Typ 1 (PH1) bei Patienten aller Altersgruppen. PH1 ist eine seltene Krankheit, bei der die Leber zu viel Oxalsäure („Oxalat“) produziert. Oxalat ist ein Endprodukt des Stoffwechsels und wird nahezu komplett über den Urin ausgeschieden. Beim Vorliegen einer PH1 kann es durch die hohen Oxalatkonzentrationen zu Ablagerungen von unlöslichem Calciumoxalat in den Nieren kommen, die zu Nierensteinbildung in den ableitenden Harnwegen und zu Nierenfunktionsstörungen führen. Auch Ablagerungen in anderen Körperteilen wie Augen, Herz, Haut und Knochen können auftreten und Schäden verursachen („Oxalose“).[6]
Lumasiran wird subkutan injiziert. Die erforderliche Dosis ist abhängig vom Körpergewicht, die Erhaltungsdosis wird alle drei Monate verabreicht.
Nebenwirkungen und Anwendungsbeschränkungen
Die in den Zulassungsstudien am häufigsten beobachteten unerwünschten Wirkungen waren Reaktionen an der Injektionsstelle und Bauchschmerzen. Lumasiran erhöht den Plasmaglykolatspiegel, was bei Patienten mit schwerer Nierenerkrankung das Risiko einer metabolischen Azidose erhöhen kann. Eine mäßige oder schwere Leberfunktionsstörung kann die Wirksamkeit vermindern.[6]
Wirkungsmechanismus
Lumasiran wirkt in den Leberzellen (Hepatozyten) mittels RNA-Interferenz auf die messenger-Ribonukleinsäure (mRNA) des Gens, das für das Enzym Glycolatoxidase (GO) kodiert. In der Folge sinkt der GO-Enzymspiegel im und dadurch die Menge an verfügbarem Glyoxylat, einem Substrat für die Bildung von Oxalat. So kann die Leber nur weniger Oxalat bilden, was die Auswirkungen der PH1 verringert.[6]
Die am sense-Strang konjugierte GalNAc-Einheit bewirkt die selektive Abgabe an die Leber dadurch, dass sie die Aufnahme über Asialoglycoproteinrezeptoren (ASGP-R) ermöglicht. Dieser Rezeptortyp wird in großer Zahl (0,5 bis 1 Million pro Zelle) hauptsächlich auf der Zelloberfläche von Hepatozyten exprimiert. Er bindet spezifisch an Glykoproteine mit endständigen Galactose- oder GalNAc-Resten. Die Bindung der GalNAc-Einheit von Lumasiran an den ASGP-R löst eine Endozytose aus und führt zur Freisetzung der siRNA in das Cytoplasma des Hepatozyten.[6]
Pharmakokinetik
Die Bindung von Lumasiran an Plasmaproteine ist mit 77 bis 85 % mittelstark bis stark. Es verteilt sich primär in der Leber (siehe Abschnitt Wirkungsmechanismus). Bei der Metabolisierung wird Lumasiran durch Endo- und Exonukleasen zu kürzeren Oligonukleotiden abgebaut. Die Elimination aus dem Plasma erfolgt hauptsächlich über die Leber. Die mittlere terminale Plasmahalbwertszeit beträgt 5,2 Stunden.[6]
Chemische Eigenschaften
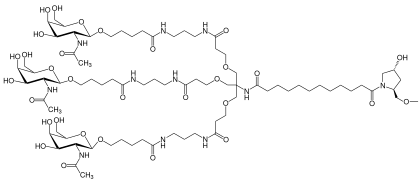
Lumasiran ist ein Konjugat aus einer siRNA mit einer verzweigten GalNAc-Verbindung (L96) am 3'-Ende des sense-Strangs. Es ist neben Givosiran, Patisiran und Inclisiran ein weiteres RNAi-Therapeutikum der Firma Alnylam[7] und wurde im November 2020 in der EU und in den USA zugelassen. Pharmazeutisch verwendet wird es als Natriumsalz.[8]
Lumasiran-Natrium ist ein hygroskopisches, weißes bis hellgelbes Pulver, das leicht löslich in Wasser ist. Alle Pentoseeinheiten der Nukleotide in Lumasiran liegen in der natürlich vorkommenden D-Ribose-Form vor. Die Chiralität der D-Ribose bleibt während der Synthese der modifizierten Konformation erhalten. Die RNA liegt in der klassischen A-Form vor.[6]
Einzelnachweise
- INN Recommended List 79, World Health Organisation (WHO), 9. März 2018.
- FDA Approves First Drug to Treat Rare Metabolic Disorder, PM FDA vom 23. November 2020, abgerufen am 31. März 2021
- Oxlumo, Website der EMA, abgerufen am 31. März 2021
- Zusammenfassung der Merkmale des Arzneimittels, EPAR der EMA, abgerufen am 9. April 2021
- Eintrag EU/3/16/1637 im Community Register of orphan medicinal products. Abgerufen am 9. April 2021.
- Assessment Report Oxlumo, Ausschuss für Humanarzneimittel der EMA, 15. Oktober 2020.
- Sven Siebenand: Inclisiran und Lumasiran vor der Zulassung, pharmazeutische-zeitung.de, 16. Oktober 2020.
- Externe Identifikatoren von bzw. Datenbank-Links zu Lumasiran-Natrium: CAS-Nummer: 1834612-06-4, Wikidata: Q105487686. Summenformel: C530H669F10N173O320P43S6Na43
- Sander F. Garrelfs, Yaacov Frishberg et al: Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1, N Engl J Med 2021; 384:1216-1226, DOI: 10.1056/NEJMoa2021712
- A Study to Evaluate Lumasiran in Children and Adults With Primary Hyperoxaluria Type 1 (ILLUMINATE-A), clinicaltrials.gov, abgerufen am 8. April 2021
- A Study of Lumasiran in Infants and Young Children With Primary Hyperoxaluria Type 1 (ILLUMINATE-B), clinicaltrials.gov, abgerufen am 8. April 2021
- A Study to Evaluate Lumasiran in Patients With Advanced Primary Hyperoxaluria Type 1 (ILLUMINATE-C), clinicaltrials.gov, abgerufen am 8. April 2021