Givosiran
Givosiran (Handelsname: Givlaari; Hersteller Alnylam Pharmaceuticals) ist ein Arzneistoff, der zur Behandlung der akuten intermittierenden Porphyrie (AIP) zugelassen wurde.[2] Es ist ein Vertreter einer vergleichsweise neuen Wirkstoffklasse, deren Wirkung auf RNA-Interferenz (RNAi) beziehungsweise RNA-Silencing (Gen-Stilllegung) beruht. In den Biowissenschaften hat sich RNA-Interferenz als eine Möglichkeit zur vorübergehenden Stilllegung von Genen („Gen-Knockdown“) etabliert. Man spricht bei dieser Substanzklasse von RNAi-Therapeutika.
| Givosiran | ||
|---|---|---|
| Masse/Länge Primärstruktur | 1711,0031 g·mol−1 | |
| Bezeichner | ||
| Externe IDs |
| |
| Weitere Angaben zum Wirkstoff | ||
|---|---|---|
| Freiname | Givosiran | |
| Andere Namen | ALN-AS1 | |
| Summenformel | C524H694F16N173O316P43S6[1] | |
| Molare Masse | 16300,49 g·mol−1 | |
| Wirkungsmechanismus | Hemmung der Aminolävulinsäuresynthase | |
Givosiran hat Orphan-Drug-Status; d. h.: es ist ein Arzneimittel gegen eine seltene Krankheit.[2] Givlaari wurde im Oktober 2021 mit dem Galenus-von-Pergamon-Preis in der Kategorie „Orphan Drugs“ ausgezeichnet.[3]
Anwendungsgebiete
Givosiran ist angezeigt zur Behandlung der akuten intermittierenden Porphyrie (AIP) bei Patienten ab 12 Jahren. Intermittierend bedeutet phasenhaft, siehe auch Krankheitsverlauf. Die AIP ist eine sehr seltene Krankheit (ultra rare disease) und eine Form der Porphyrien. Dabei handelt es sich um meist angeborene Störungen der Häm-Biosynthese, bei denen es aufgrund eines Enzym-Defektes zur Überproduktion, Anhäufung und vermehrten Ausscheidung von Zwischenprodukten der Hämsynthese, den sogenannten Porphyrinen, kommt. Unterschieden werden erythropoetische (die Blutbildung betreffende) und hepatische (die Leber betreffende) Porphyrien.[4]
Wirkungsmechanismus
Givosiran inhibiert die Aminolävulinsäuresynthase, welche in der Hämoglobinsynthese eine relevante Rolle spielt.
Chemische Struktur
Givosiran ist eine doppelsträngige, kleine interferierende Ribonukleinsäure (small interfering RNA, siRNA). Givosiran ist ein Konjugat aus einer siRNA mit einer verzweigten GalNAc-Verbindung. In der doppelsträngigen siRNA sind die Basenpaare als Kombination aus 2'-Deoxy-2'-fluor- und 2'-O-Methylnukleotiden wie folgt angeordnet:[1]
(5'-3') U=G=G-U-C-U-U-U-C-U-C-A-C-A-G-A-G-U-A-G-A=A=U
Legende:
C ≙ Cytidin, A ≙ Adenosin, G ≙ Guanosin, U ≙ Uridin
X ≙ 2'-O-Methyl-X,
X ≙ 2'-Deoxy-2'-fluor-X
- ≙ Phosphodiesterbindung
= ≙ Phosphorthioatbindung (Phosphodiesterbindung, bei dem die Hydroxygruppe durch eine Thiolgruppe ausgetauscht ist)
R1 = 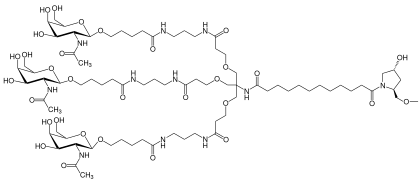
Die GalNAc-Konjugattechnologie („Enhanced Stabilization Chemistry“, ESC)[5] ermöglicht die subkutane Gabe und bewirkt die Freisetzung der siRNA in der Leber.
Pharmazeutisch verwendet wird Givosiran als Natriumsalz, ein weißes bis blassgelbes, hygroskopisches Pulver, das sich leicht in Wasser löst.[6]
Studien
- EXPLORE: A prospective, multinational, observational study characterizing the natural history and clinical management of AHP patients with recurrent attacks (3 or more attacks/year) or who receive hemin or gonadotropin-releasing hormone analogue prophylaxis to prevent attacks.[7]
- OLE (open-label extension): A Study to Evaluate Long-term Safety and Clinical Activity of ALN-AS1 in Patient With Acute Intermittent Porphyria (AIP)[8]
- ENVISION: Manisha Balwani, Eliane Sardh et. al: Phase 3 Trial of RNAi Therapeutic Givosiran for Acute Intermittent Porphyria, N Engl J Med 2020; 382:2289-2301; DOI: 10.1056/NEJMoa1913147[9]
Zulassung / Frühe Nutzenbewertung
Die Zulassung von Givlaari erfolgte im November 2019 in den USA[10] und im März 2020 in der EU.[11]
Vorangegangen war in den USA im Mai 2017 die Zuerkennung eines Breakthrough Therapy-Status zur Prophylaxe von akuten Schüben bei Patienten mit einer Akuten hepatischen Porphyrie[12] Das bedeutet ein beschleunigtes Zulassungsverfahren, das dem Medikament auch in der EU als „priority medicine“ (PRIME) seitens der europäischen Arzneimittel-Agentur (EMA) eingeräumt wurde.[13] Givosiran hat sowohl in den USA als auch in der EU den Orphan Drug Status.[14]
In der EU erfolgte im Januar 2020 eine positive Empfehlung seitens der EMA für eine Zulassung,[15] wenig später die Zulassungserteilung durch die Europäische Kommission.
Givosiran hat bereits die frühe Nutzenbewertung nach § 35a SGB V durchlaufen. Der Gemeinsame Bundesausschuss (G-BA) attestiert Givosiran einen „Hinweis auf einen beträchtlichen Zusatznutzen“.[16]
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Givlaari
Einzelnachweise
- World Health Organisation: International Nonproprietary Names for Pharmaceutical Substances (INN) - Recommended International Nonproprietary Names: List 76. In: WHO Drug Information. 30, Nr. 3, 2016.
- ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS, EPAR der EMA, abgerufen am 8. April 2021
- Galenus-Gewinner – Orphan Drugs, Ärztezeitung vom 21. Oktober 2021, abgerufen am 22. Oktober 2021
- Thomas Kia (Hrsg.): AllEx - Alles fürs Examen. 1. Auflage. Georg Thieme Verlag KG, 2012, ISBN 978-3-13-146951-9, S. 345.
- M. Manoharan: GalNAc-siRNA with Enhanced Stabilization Chemistry, Alnylam Pharmaceuticals, März 2014.
- Committee for Medicinal Products for Human Use (CHMP): Assessment report - Givlaari (PDF). Hrsg.: Europäische Arzneimittelagentur. 30. Januar 2020.
- Initial Evidence of Clinical Activity Shown with Givosiran (ALN-AS1) in Acute Intermittent Porphyria Patients with Recurrent Attacks (Memento vom 7. Februar 2017 im Internet Archive), PM Alnylam vom 12. März 2016, abgerufen am 6. August 2017
- A Study to Evaluate Long-term Safety and Clinical Activity of ALN-AS1 in Patient With Acute Intermittent Porphyria (AIP).
- ENVISION: A Study to Evaluate the Efficacy and Safety of Givosiran (ALN-AS1) in Patients With Acute Hepatic Porphyrias (AHP), clinicaltrials.gov, abgerufen am 8. April 2021
- FDA approves first treatment for inherited rare disease. In: FDA. 20. November 2019, abgerufen am 16. März 2020.
- K. Graefe: Erstes Medikament für seltene Erbkrankheit, Pharmazeutische Zeitung, 10. März 2020.
- FDA Grants Breakthrough Therapy Designation for Alnylam's Givosiran for the Prophylaxis of Attacks in Patients with Acute Hepatic Porphyria (Memento vom 7. August 2017 im Internet Archive), PM Alnylam vom 31. Mai 2017, abgerufen am 6. August 2017.
- Alnylam Receives European Medicines Agency PRIME Designation for Accelerated Assessment of Givosiran, an Investigational RNAi Therapeutic for the Treatment of Acute Hepatic Porphyrias (Memento vom 7. August 2017 im Internet Archive), PM Alnylam vom 1. März 2017, abgerufen am 6. August 2017.
- Data Presented at ICPP Show Encouraging Results for Givosiran in AHP Patients (Memento vom 7. August 2017 im Internet Archive), RareDiseaseReport vom 26. Juni 2017, abgerufen am 6. August 2017.
- Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 27-30 January 2020PM der EMA vom 31. Januar 2020, abgerufen am 31. Januar 2020
- Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Givosiran, G-BA vom 15. Oktober 2020, abgerufen am 8. April 2021