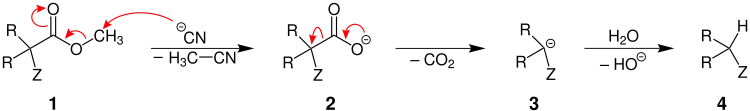Krapcho-Decarboxylierung
Die Krapcho-Decarboxylierung, manchmal auch als Krapcho-Reaktion oder Krapcho-Decarbalkoxylation bezeichnet, ist eine Namensreaktion der organischen Chemie. Benannt wurde die Reaktion nach ihrem Entdecker Andrew Paul Krapcho, der sie 1967 veröffentlichte.[1] Mit Hilfe dieser Reaktion lassen sich α,α-disubstituierte Ester und α-monosubstituierte Ester decarboxylieren.[2][3][4]
Übersicht
Die Reaktion findet in einem aprotisch-polaren Lösungsmittel (z. B. DMSO, DMF, DMA oder HMPT) statt. Bei der Reaktion von Estern, die in α-Stellung einen elektronenziehenden Rest (hier als X dargestellt) besitzen, mit Cyanidionen (z. B. aus KCN) wird der Ester decarboxyliert und Kohlenstoffdioxid wird als Gas frei.[5]
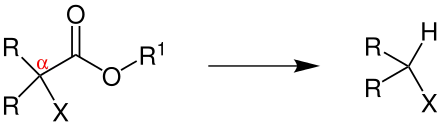 R = Wasserstoff, Alkylgruppe, Arylgruppe, die Reste können gleich, aber auch verschieden sein; R1 = Alkylgruppe; X = elektronenziehende Gruppe, wie Nitrilgruppe, Estergruppe, Carbonylgruppe oder Sulfongruppe[1][6]
R = Wasserstoff, Alkylgruppe, Arylgruppe, die Reste können gleich, aber auch verschieden sein; R1 = Alkylgruppe; X = elektronenziehende Gruppe, wie Nitrilgruppe, Estergruppe, Carbonylgruppe oder Sulfongruppe[1][6]
Anstelle von Kaliumcyanid kann die Reaktion auch mit anderen Salzen durchgeführt werden: NaCN, LiCl, NaCl, NaBr, NaI, LiI·H2O, Na2CO3·H2O, Na3PO4·12 H2O.[6]
Mechanismus
Der Verlauf des Mechanismus hängt von den Resten R ab, die am α-Kohlenstoffatom gebunden sind.
α,α-disubstituierte Ester
Sind beide Reste R von Wasserstoff verschieden, ist der Ester also α,α-disubstituiert, greift das Salz (hier durch das Cyanidanion dargestellt) die Alkylgruppe (hier eine Methylgruppe) 1 im Zuge einer SN2-Reaktion an und geht als Methylcyanid ab. Zurück bleibt ein Carboxylat 2 aus dem nun durch Umlagerung von Elektronen Kohlenstoffdioxid abgespalten wird und ein Carbanion 3 als Übergangszustand entsteht. Dieses wird durch Wasser zum decarboxylierten Produkt 4 protoniert.[1][6]
α-monosubstituierte Ester
Gilt für den einen Rest R = H, ist das Edukt ein α-monosubstituierter Ester 5. In diesem Fall greift das Cyanidion die Carbonylgruppe 5 an und es entsteht ein tetraedrischer Übergangszustand 6. Unter Ausbildung einer C=O-Doppelbindung entsteht zum einen das Carbanion 3, dass auch bei α,α-disubstituierten Estern entstanden ist, und zum anderen Cyanameisensäureethylester (7). Das Carbanion 3 wird wiederum von Wasser zum Produkt 4 protoniert. Der Cyanameisensäureethylester (7) reagiert mit Wasser unter Abspaltung von Blausäure und Kohlenstoffdioxid zum Nebenprodukt 8 in Form eines Alkohols.[1][6]
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1687 f.
- A. P. Krapcho, E. G. E. Jahngen Jr., A. J. Lovey: Decarbalkoxylations of geminal diesters and β-keto esters in wet dimethyl sulfoxide. Effect of added sodium chloride on the decarbalkoxylation rates of mono- and di-substituted Malonate esters. In: Tetrahedron Letters. Band 15, Nr. 13, 1974, S. 1091–1094, doi:10.1016/S0040-4039(01)82414-X.
- A. P. Krapcho, J. F. Weimaster, J. M. Eldridge, E. G. E. Jahngen Jr., A. J. Lovey, W. P. Stephens: Synthetic applications and mechanism studies of the decarbalkoxylations of geminal diesters and related systems effected in dimethyl sulfoxide by water and/or by water with added salts. In: J. Org. Chem. Band 43, Nr. 1, 1978, S. 138–147, doi:10.1021/jo00395a032.
- A. P. Krapcho, G. A. Glynn, B. J. Grenon: The decarbethoxylation of geminal dicarbethoxy compounds. In: Tetrahedron Letters. Band 8, Nr. 3, 1967, S. 215–217, doi:10.1016/S0040-4039(00)90519-7.
- J. J. Li: Name Reactions. A Collection of Detailed Reaction Mechanisms. 3. erweiterte Auflage, Springer, Berlin/Heidelberg 2006, ISBN 978-3-540-30030-4, S. 230.
- L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 252.