Matrixprotein 2 (Influenzavirus A)
Das Matrixprotein 2 (M2) ist ein Membranprotein in der Virushülle von Mitgliedern der Gattung Influenzavirus A. M2 ermöglicht den Zufluss von Protonen in das Virusinnere, nachdem das Virus innerhalb eines Lysosoms in die Zielzelle eingedrungen ist. Innerhalb des Lysosoms herrscht ein niedriger pH-Wert, was zum Einströmen der Protonen und Ansäuerung im Virusinneren führt. Dadurch kommt es zu einer Konformationsänderung des Hämagglutinins in der Virushülle und zum Ausstülpen einer Fusionssequenz, die eine Verschmelzung von Virushülle und Membran des Lysosoms einleitet. Nach dieser Verschmelzung wird das Virusinnere mit den RNA-haltigen Viruskapsiden in das Zytosol freigegeben. Das M2-Protein ist in der Funktion des Protonentransports ein Transportprotein und hat die Form eines Kanals.[1]
| Matrixprotein 2 (Influenzavirus A) | ||
|---|---|---|
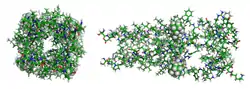 | ||
| Stäbchenmodell des Tetramer komplexiert mit Rimantadin (Kalotten) von oben und seitlich, nach PDB 2RLF | ||
| Masse/Länge Primärstruktur | 97 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Isoformen | M1, M2 | |
| Bezeichner | ||
| Gen-Name(n) | M | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 1.A.19.1.1 | |
| Bezeichnung | Influenza A/M2-Kanal | |
| Vorkommen | ||
| Übergeordnetes Taxon | Influenzavirus A | |
Das Matrixprotein M2 ist eines der drei integralen Membranproteine des Influenzavirus-Virions und eines der drei Proteine mit Anteilen auf der Virusoberfläche. Die messenger-RNA für das M2-Protein entsteht nach dem Spleißen.[2] Gegen Ende des Infektionszyklus, wenn die Oberflächenproteine des Virus in der Zellmembran verankert werden, ist das M2-Protein bei der Entfernung von Protonen aus den Golgi-Vesikeln beteiligt, in denen die Virusproteine zur Zellmembran transportiert werden.
Mutationen im transmembranären Bereich des M2-Proteins sind für einen Teil der Resistenzen gegen Medikamente (Amantadin) verantwortlich.[3] Ein Histidin an der Position 37 leitet bei seiner Protonierung die Öffnung des Ionenkanals ein.
Einzelnachweise
- UniProt P35938
- Chizhmakov IV, Geraghty FM, Ogden DC, Hayhurst A, Antoniou M, Hay AJ: Selective proton permeability and pH regulation of the influenza virus M2 channel expressed in mouse erythroleukaemia cells. J. Physiol. (1996) 494:329–36
- Hay AJ, Wolstenholme AJ, Skehel JJ, Smith MH. 1985. The molecular basis of the specific anti-influenza action of amantadine. EMBO J. 4:3021–24
Weblinks
- Transport Classification Database: The Type A Influenza Virus Matrix-2 Channel (M2-C) Family
- Proteopedia: Protonenkanäle (mit Animation des M2-Proteins)