Hexafluorisopropanol
Hexafluorisopropanol oder Hexafluor-2-propanol, abgekürzt HFIP, ist eine organische Verbindung mit der Formel (CF3)2CHOH. Dieser fluorierte Alkohol wird als Lösungsmittel eingesetzt. Die farblose, flüchtige Flüssigkeit ist durch einen starken, stechenden Geruch gekennzeichnet. HFIP ist mischbar mit Wasser, Methanol, 2-Propanol und Hexanen, aber unmischbar mit Acetonitril.[4] Dabei reagiert HFIP in Wasser als schwache Säure, da die elektronenziehenden CF3-Gruppen die Acidität der OH-Gruppe erhöhen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
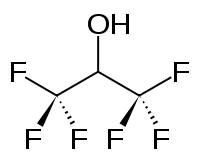 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,1,1,3,3,3-Hexafluor-2-propanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H2F6O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 168,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,596 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
59 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
176 g/l in Wasser bei 20 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Treibhauspotential |
221 (bezogen auf 100 Jahre)[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hexafluorisopropanol als Lösungsmittel zeichnet sich durch eine hohe Polarität (ENT = 1.07) sowie als starker Wasserstoffbrücken-Donor aus. Es ist dagegen jedoch nur ein schwacher Wasserstoffbrücken-Akzeptor und besitzt eine niedrige Nukleophilie.[5]
Verwendung
Hexafluorisopropanol ist ein Speziallösungsmittel für einige polare Polymere und wird für bestimmte organische Synthesen eingesetzt. Mit Hexafluorisopropanol lassen sich auch Kunststoffe lösen, welche in den gängigsten organischen Lösungsmitteln nicht löslich sind. Zu diesen Kunststoffen zählen z. B.: Polyamide, Polyacrylnitrile, Polyacetale, Polyester und Polyketone.[7][8] Aufgrund seiner Acidität (pKs = 9,3) kann es als Säure in flüchtigen Puffern für Ionenpaar-HPLC - Massenspektrometrie von Nukleinsäuren verwendet werden.[9] Es wurde erfolgreich als Lösemittel für die direkte elektrochemische Synthese von Sulfonamiden aus Arenen eingesetzt.[10]
Sicherheit
Hexafluorisopropanol ist eine flüchtige, ätzende Flüssigkeit, die schwere Verätzungen und Atembeschwerden verursachen kann. Bei längerer oder wiederholter Exposition kann Hexafluorisopropanol vermutlich die Fruchtbarkeit beeinträchtigen sowie das Kind im Mutterleib schädigen.[1]
Umwelt
Die Freisetzung von Hexafluorisopropanol in die Umwelt ist zu vermeiden. Per- und Polyfluorierte Verbindungen, sogenannte PFAS, zu denen Hexafluorisopropanol zählt,[11] gelten aufgrund ihrer Fluorierung als in der Natur nicht abbaubare Stoffe. Daher werden sie als langlebige organische Schadstoffe eingeordnet. Bedingt durch die gute Wasserlöslichkeit von Hexafluoroisopropanol ist es darüber hinaus sehr mobil. Damit zählt Hexafluorisopropanol als vPvM/PMT-Substanz (sehr persistente, mobile Stoffe, die ggf. ein toxisches Potenzial aufweisen).[12] Als leichtflüchtige und fluorierte Substanz verstärkt Hexafluorisopropanol die Erderwärmung. Es hat ein Treibhauspotential (GWP) von 221 und ist damit 221-mal schädlicher für die Atmosphäre als CO2.[13]
Einzelnachweise
- Datenblatt: 1,1,1,3,3,3-Hexafluoro-2-propanol. Version 6.6 Sigma Aldrich, 11. Mai 2020, abgerufen am 20. Dezember 2020.
- Stephen S. Szinai, George Crank, David R. K. Harding: Perfluoroalkyl carbonyl compounds. 2. Derivatives of hexafluoroacetone. In: Journal of Medicinal Chemistry. Band 13, Nr. 6, November 1970, ISSN 0022-2623, S. 1215–1217, doi:10.1021/jm00300a045 (acs.org [abgerufen am 20. Dezember 2020]).
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- A. Apffel, J. A. Chakel, S. Fisher, K. Lichtenwalter, W. S. Hancock: Analisis of Oligonucleotides by HPLC-Electrospray Ionization Mass Spectroscopy. In: Anal. Chem. 69, 1997, S. 1320–1325.
- Jean-Pierre Bégué, Danièle Bonnet-Delpon, Benoit Crousse: Fluorinated Alcohols: A New Medium for Selective and Clean Reaction. In: Synlett. Nr. 1, 2004, ISSN 0936-5214, S. 18–29, doi:10.1055/s-2003-44973 (thieme-connect.de [abgerufen am 20. Dezember 2020]).
- Patent US4314087: Methods of synthesizing hexafluoroisopropanol from impure mixtures and synthesis of a fluoromethyl ether therefrom. Angemeldet am 26. Dezember 1979, veröffentlicht am 2. Februar 1982, Anmelder: Baxter Travenol Laboratories, Erfinder: Phillip C. Radlick.
- Jean-Pierre Bégué, Danièle Bonnet-Delpon, Benoit Crousse: Fluorinated Alcohols: A New Medium for Selective and Clean Reaction. In: Synlett. Nr. 1, 2004, ISSN 0936-5214, S. 18–29, doi:10.1055/s-2003-44973 (thieme-connect.de [abgerufen am 20. Dezember 2020]).
- Ivan Shuklov, Natalia Dubrovina, Armin Börner: Fluorinated Alcohols as Solvents, Cosolvents and Additives in Homogeneous Catalysis. In: Synthesis. Band 2007, Nr. 19, Oktober 2007, ISSN 0039-7881, S. 2925–2943, doi:10.1055/s-2007-983902 (thieme-connect.de [abgerufen am 20. Dezember 2020]).
- A. Apffel, J.A. Chakel, S. Fischer, K. Lichtenwalter, W.S. Hancock: Fluorinated Alcohols: A New Medium for Selective and Clean Reaction. In: ANAL. CHEM. Band 69, Nr. 1320-1325, 1997.
- Stephan P. Blum, Tarik Karakaya, Dr. Dieter Schollmeyer, Dr. Artis Klapars, Prof. Dr. Siegfried R. Waldvogel: Metal‐Free Electrochemical Synthesis of Sulfonamides Directly from (Hetero)arenes, SO2, and Amines. In: Angewandte Chemie International Edition. Band 60, Nr. 10, 1. März 2021, ISSN 0570-0833, S. 5056–5062, doi:10.1002/anie.202016164 (wiley.com [abgerufen am 9. April 2021]).
- PFAS|EPA: PFAS structures in DSSTox. In: CompTox. United Stated Environmental Protection Agency, abgerufen am 20. Dezember 2020.
- Hans Peter H. Arp, Sarah E. Hale: REACH: Improvement of guidance and methods for the identification and assessment of PMT/vPvM substances. Umweltbundesamt, November 2019, abgerufen am 20. Dezember 2020.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).

