Hämatoxylin
Hämatoxylin oder Hämalaun ist eine natürliche chemische Verbindung aus der Gruppe der Indenochromene und der Polyphenole. Sie wird aus dem Kernholz des Blauholzbaums (Haematoxylum campechianum) gewonnen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
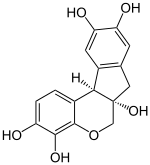 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hämatoxylin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H14O6·xH2O | ||||||||||||||||||
| Kurzbeschreibung |
lichtempfindlicher gelbbrauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 302,29 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gering löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Die bereits zuvor in Amerika genutzten Blauholzextrakte wurden erstmals durch den spanischen Konquistador Hernán Cortés im Jahre 1520 nach Europa gebracht. Seine erste schriftliche Erwähnung als Farbstoff ging auf Robert Hooke im Jahr 1665 zurück. Quekett (1848) und Waldeyer (1863) führten diesen Farbstoff in die Histochemie ein. Die Resultate waren jedoch nicht befriedigend, da beide diesen Farbstoff direkt einsetzten. Die heute noch verwendete kombinierte Anwendung von Hämatoxylin und einem Metallsalz geht auf Böhmer (1865) zurück.
Gewinnung
Hämatoxylin wird durch Extraktion aus dem Kernholz des Blauholzbaums gewonnen. Dazu wird primär ein wässriger Extrakt hergestellt, der nach einer Extraktion mit Ether eingeengt wird. Alternativ kann Hämatoxylin auch aus dem wässrigen Extrakt durch Fällung mit Harnstoff gewonnen werden. Eine synthetische Herstellung von Hämatoxylin ist ebenso beschrieben.
Eigenschaften
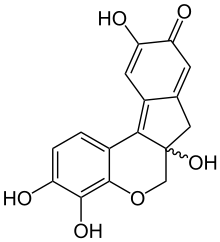
In seiner reinen Form ist Hämatoxylin farblos bis beige. Durch Oxidation mittels Luftsauerstoff (langsam) oder einem geeigneten Oxidationsmittel (z. B. Natriumiodat, Kaliumpermanganat, Wasserstoffperoxid oder Iod) entsteht in wässriger oder alkoholischer Lösung aus Hämatoxylin das ockerbraun gefärbte Hämatein. Diesen Vorgang nennt man auch (natürliche bzw. künstliche) „Reifung“. Hämatein ist ein leicht saurer Farbstoff. Die gewünschte färbende Wirkung wird erst durch den Zusatz mehrwertiger Metall-Kationen als Beize erreicht. In Gegenwart mehrwertiger Kationen, wie z. B. Eisen (Fe3+) und Aluminium (Al3+) bilden sich Farbstoffkomplexe durch Chelatbildung in der Stöchiometrie 1:1. Komplexe aus Hämatein und Alaunen werden dabei als Hämalaune bezeichnet. Hämalaune zeigen die typische dunkelblau-violette Farbe und werden auch als Hämatoxylinlack (eigentlich Hämateinlack) bezeichnet.
Für die Herstellung von hämatoxylinhaltigen Farblösungen gibt es über 100 verschiedene Rezepte. Weit verbreitet ist die Verwendung von Hämatoxylin nach Mayer, Harris, Gill (Hämalaune) und Weigert (Eisenhämatoxylin). Diese Farblösungen enthalten den basischen Farblack in saurem Milieu (pH 3–4). Die Anbindung des Farblacks an das Substrat erfolgt wiederum durch Chelatbildung an mehrwertige Kationen mit anionischen Strukturen (z. B. Phosphatgruppen der Nukleinsäuren des Zellkerns). Diese Kombination aus kovalenter und koordinativer Bindung ist stabil genug, um nachfolgende Spülschritte in Wasser und Alkohol zu überstehen. Bei dem niedrigen pH-Wert der Färbelösung erscheinen die gefärbten Strukturen rötlich-braun, erst durch Anheben des pH-Wertes durch Spülen in Leitungswasser (pH 6,8–7,0) entsteht die typische blau-violette Färbung.
Durch Variation des pH-Wertes kann eine Selektivität für verschiedene Strukturen erreicht werden. Während bei einem pH-Wert von > 4,5 zahlreiche Zellstrukturen gefärbt werden, dominiert bei einem pH-Wert von 2–3 die Anfärbung von Zellkernen. Brasilin fehlt im Vergleich zu dem Farbstoff Hämatoxylin eine Hydroxygruppe.
Verwendung
Es wird insbesondere in der Histologie zum Färben von Zell- und Gewebestrukturen, wie z. B. Zellkernen, Mitochondrien, Myelin, Elastin und Kollagenfasern eingesetzt. Darüber hinaus fand Hämatoxylin in der Färberei und in der Tintenproduktion Anwendung.
Histologie
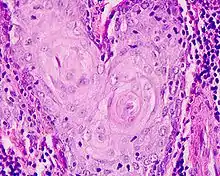
In der Histologie wird Hämatoxylin zum Färben von Zell- und Gewebestrukturen, wie z. B. Zellkernen, Mitochondrien, Myelin, Elastin und Kollagenfasern eingesetzt.[3] Zahlreiche Varianten der Hämatoxylinfarblösungen wurden entwickelt, die sich insbesondere in der Hämatoxylinkonzentration, der Wahl des Oxidationsmittels sowie der Wahl des Kations (Beize) und somit im Färbeverhalten unterscheiden. Beispiele hierfür sind die Farblösungen nach Harris, Ehrlich, Mayer, Weigert, Heidenhain und Verhoeff.
In Kombination mit der Hämatoxylin-Färbung (Zellkernfärbung) wird in der Regel eine Gegenfärbung mit einem kontrastreichen Zytoplasmafarbstoff durchgeführt. Klassisch wird eine Gegenfärbung mit Eosin durchgeführt (Hämatoxylin-Eosin-Färbung), bei der kationische/eosinophile Strukturen (z. B. Proteine) angefärbt werden. Hierbei werden Zellkerne üblicherweise dunkelblau eingefärbt, während die anderen Zellbestandteile hellrosa bis pink erscheinen. Für die HE-Färbung werden Hämalaune eingesetzt. Bei Bindegewebsfärbungen (z. B. Van-Gieson-Färbung, Masson-Trichrom-Färbung) findet man üblicherweise die Eisenhämatoxylinlösung nach Weigert in Kombination mit anderen sauren Farbstoffen (z. B. Pikrofuchsin, Anilinblau, Orange G, Säurefuchsin, u. v. m.). Bei der Immunohistochemie wird eine Kernfärbung mit Hämalaun als Gegenfärbung angeschlossen. Das Färbeergebnis zeigt hier positive Reaktionen in rötlich-braun (DAB) mit zart-blauen Kernen.
Weblinks
Einzelnachweise
- Datenblatt Hematoxylin hydrate, 96% (dry wt.), water ca 6% bei AlfaAesar, abgerufen am 19. Juni 2013 (PDF) (JavaScript erforderlich).
- Eintrag zu Haematoxylin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Godwin Avwioro (2011): Histochemical Uses Of Haematoxylin - A Review. In: Journal of Pharmacy and Clinical Sciences. Bd. 1, S. 24–34. (PDF; 303 kB)
