Elastin
Elastin (bzw. sein löslicher Vorläufer Tropoelastin) ist ein Faserprotein in Wirbeltieren mit Ausnahme der Rundmäuler. Es gehört zu den Strukturproteinen, weil es in seiner Funktion für Formgebung und Halt verantwortlich ist, insbesondere sorgt es für die Dehnungsfähigkeit großer Blutgefäße wie der Aorta. Mutationen im ELN-Gen können erbliche Erkrankungen verursachen, wie Dermatochalasis, Williams-Beuren-Syndrom, Cutis Laxa und supravalvuläre angeborene Aortenstenose (SVAS).[2]
| Elastin | ||
|---|---|---|
| ||
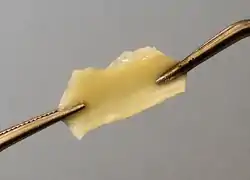
| Gedehntes, aus einer Rinderaorta isoliertes Elastin | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 68,4 kDa; 786 Aminosäuren (kanonische Sequenz, Isoform 3) | |
| Präkursor | Tropoelastin | |
| Isoformen | 13 | |
| Bezeichner | ||
| Gen-Name | ELN | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Die Zusammensetzung von Elastin ist ähnlich derer von Kollagen, jedoch enthält sie kein Hydroxylysin, dafür allerdings einen beträchtlichen Anteil von Valin (15,6 %). Lysinreste können durch das Enzym Lysyloxidase (EC 1.4.3.13) zu Allysin oxidiert sein. Jeweils 3 Allysine und ein Lysin können in ein ringförmiges Desmosin oder in sein Isomer Isodesmosin umgewandelt vorliegen,[3] was zur Elastizität des Gesamtmoleküls beiträgt.
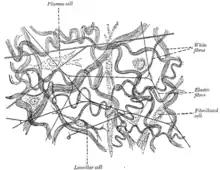
Elastin ist ein Proteinnetzwerk und besteht aus vernetzten Elastin-Einheiten. Elastin wird von den Zellen in löslicher Form sezerniert und anschließend durch das Enzym Lysyloxidase (LOX) vernetzt. Die Aminosäure Lysin ist verantwortlich für diese Quervernetzung. Elastin ist ein äußerst langlebiges Protein mit einer Halbwertszeit von 74 Jahren. Die Bildung Elastins beginnt bereits vor der Geburt und setzt sich beim Menschen in den ersten Lebensjahren fort. Danach wird praktisch kein neues, funktionstüchtiges Elastin gebildet. Elastin besitzt eine hohe Resistenz gegenüber Proteasen. Proteasen, die Elastin spalten können, werden als Elastasen bezeichnet. Zu dieser Familie gehören verschiedene Serinproteasen wie Pankreaselastase oder Cathepsin G, Metalloproteasen wie MMP-12 sowie Cysteinproteasen, z. B. Cathepsin K, L oder S.
Im Gegensatz zu Kollagen ist Elastin elastisch dehnbar, genauer entropieelastisch[4]. Elastin kommt unter anderem in der Lunge, in der Haut und in Blutgefäßen vor und verleiht diesen Elastizität und Spannkraft. Es kann auch in der Gewebezüchtung zur Herstellung von Ersatzarterien genutzt werden.[4]
Struktur
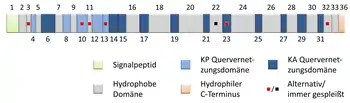
Humanes Tropoelastin besitzt je nach Spleißvariante eine Molekülmasse zwischen 49 und 69 kDa und besteht den folgenden beiden Domänentypen, die alternierend angeordnet sind:
- Hydrophobe Domänen, die aus Wiederholungseinheiten der Aminosäuren Glycin (G), Valin (V), Prolin (P) und Alanin (A) aufgebaut sind. Sich häufig wiederholende Sequenzmotive sind z. B. VPGVG, GGVP oder GVGVAP.
- Hydrophile Domänen, die typischerweise reich an Lysin (K), Prolin und Alanin sind. Diese Domänen werden zum Vernetzen benötigt. Sie bestehen aus Bereichen, in denen ein Lysin vom nächsten durch zwei oder drei Alanine getrennt ist (z. B. AAAKAAKAA) oder in denen Lysin neben Prolin (z. B. KPLKP) liegt.
Stoffwechsel und Synthese
Lösliches Elastin wird von verschiedenen Zellen sezerniert und sofort nach dem Verlassen der Zelle in der extrazellulären Matrix zu Elastin vernetzt. Die Vernetzung geschieht durch das kupferabhängige Enzym Lysyloxidase, das die ε-Aminogruppen des Lysins unter Freisetzung von Wasserstoffperoxid und Ammoniak oxidiert. Es entsteht dabei α-Amino-Adipin-δ-Semialdehyd (Allysin). Dieses kann mit einem weiteren freien Amin zu einem Dehydrolysinonorleucin vernetzen, wohingegen bei der Kondensation zweier Allysine Allysinaldol entsteht. Diese beiden Produkte können dann zu Desmosin weiterkondensieren.
Da Tropoelastin in vivo sehr schnell vernetzt wird, liegt es im Gewebe nur in äußerst geringen Konzentrationen vor. Der Nachweis von Tropoelastin gelang durch die Aufzucht von Tieren, bei denen die Produktion von aktiver Lysyloxidase gehemmt wurde.
Einzelnachweise
- InterPro-Eintrag
- UniProt P15502
- Eintrag zu Desmosine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. März 2011.
- Oliver Türk: Stoffliche Nutzung nachwachsender Rohstoffe. 1. Auflage. Springer Vieweg, Wiesbaden 2014, ISBN 978-3-8348-1763-1, S. 159.