Hämatein
Hematein ist eine chemische Verbindung aus der Gruppe der Neoflavonoide. Es ist das Oxidationsprodukt des Hämatoxylins.[2] In Anwesenheit von Aluminium-Ionen bindet es an Nukleinsäuren.[3] Dadurch werden DNA in Zellkernen und RNA im Zytosol angefärbt.[4] Daneben bindet es auch an Keratohyalin-Granula und Hydroxyapatit. Ein Analogon des Hämateins ist das Brasilein.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
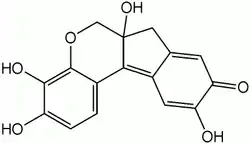 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hämatein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H12O6 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 300,26 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Im frisch gefällten Zustande erscheint Hämatein als ein aufgequollener Niederschlag von rotbrauner Farbe. Getrocknet ist es dunkelgrün, metallisch glänzend und in dünnen Schichten rot durchscheinend, sein Strichpulver ist rotbraun. Es löst sich langsam in kaltem und leichter in siedendem Wasser. In Salpetersäure löst es sich anfangs mit purpurroter Farbe, die aber bald in Gelb übergeht.[5] Es bindet sich an eine große Zahl von Metallionen wie zum Beispiel Cr3+, Al3+ oder Fe3+/Fe2+.[6] In wässrigen Lösungen mit Aluminiumionen (als Mordant) liegt Hämatein in drei Formen vor, als gelbes freies Hämatein, mit einem Aluminiumion als rotes Hämatein und mit zwei Aluminiumionen als blauviolettes Hämatein.[7] Hämatein wird durch Oxidation von Hämatoxylin erzeugt, entweder durch dreimonatige Oxidation mit Luftsauerstoff (Ehrlichs Hämatoxylin oder Delafields Hämatoxylin), mit Natriumiodat (Mayers Hämatoxylin) oder mit Quecksilberoxid (Harris' Hämatoxylin).[8] Sowohl die Bindung von Aluminiumionen als auch die Erhöhung des pH-Werts erzeugt eine bathochrome Farbveränderung von einem Absorptionsmaximum bei einer Wellenlänge von 445 nm zu 560 nm.[9]
Einzelnachweise
- Datenblatt Hematein, for microscopy (Hist.) bei Sigma-Aldrich, abgerufen am 4. November 2017 (PDF).
- Kazuko Shirai, Masaru Matsuoka: Structure and properties of hematein derivatives. In: Dyes and Pigments (1996), Band 32, Heft 3, S. 159–169. doi:0143-7208(96)00022-8.
- H. Puchtler, S. N. Meloan, F. S. Waldrop: Application of current chemical concepts to metal-hematein and -brazilein stains. In: Histochemistry. Band 85, Nummer 5, 1986, S. 353–364, PMID 2430916.
- C. Bettinger, H. W. Zimmermann: New investigations on hematoxylin, hematein, and hematein-aluminium complexes. II. Hematein-aluminium complexes and hemalum staining. In: Histochemistry. Band 96, Nummer 3, 1991, S. 215–228, PMID 1717413.
- Carl Löwig: Chemie der organischen Verbindungen. F. Vieweg, 1846, S. 867.
- Anil B. Amin, Liisa Mortensen, Trygve T. Poppe: Histology Atlas, Normal Structure of Salmonids A Colour Atlas, English, German, French and Spanish Legends. Histology atlas: salmonids, 1992, ISBN 978-82-992406-1-1, S. 176.
- Gary Gill: Cytopreparation. Springer Science & Business Media, 2012, ISBN 978-1-461-44933-1, S. 165.
- John D. Bancroft: Theory and Practice of Histological Techniques. Elsevier Health Sciences, 2008, ISBN 978-0-443-10279-0, S. 121.
- Catherine E. Housecroft: Chemistry. Pearson Education, 2010, ISBN 978-0-273-73308-9, S. 440.