Gasotransmitter
Gasotransmitter sind unter Standardbedingungen gasförmige Stoffe, die in Zellen synthetisiert werden und in der interzellularen Kommunikation eine wichtige Rolle spielen. Zu ihnen zählen Stickstoffmonoxid (NO), Schwefelwasserstoff (H2S), Kohlenmonoxid (CO) und gegebenenfalls Distickstoffmonoxid (Lachgas N2O).[1]
Allgemeines
Gasotransmitter gehören zu einer Familie endogener Gasmoleküle oder gasförmiger Signalmoleküle, so NO, CO, H2S, und andere. Diese Gase haben viele gemeinsame Merkmale, so in ihrer zellulären Produktion und Funktion, ferner sind sie in ihren biologischen Aufgaben in einzigartiger Weise charakterisiert, die sie von klassischen Signalmolekülen unterscheiden. Ihre Verbreitung ist ubiquitär vom einzelligen bis zum vielzelligen Organismus, sie kommen in allen Domänen vor. Es sind phylogenetisch betrachtet sehr alte zellulare Kommunikationsprinzipien.
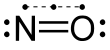
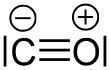

Erstmals wies im Jahre 1981 eine klinische Arbeit auf die pharmakologischen Wirkungen der Gasotransmitter auf entsprechende Rezeptoren und als Neurotransmitter[2][3][4] hin.
Ein In-vitro-Experiment bestätigte diese Beobachtungen.[5] Eine verbindliche Terminologie und Charakterisierung für das Kriterium „Gasotransmitter“ wurde dann im Jahr 2002 eingeführt.[6]
Ein Gas kann als Gasotransmitter kategorisiert werden, wenn seine Moleküle folgende Kriterien erfüllen:[7][6]
- Sie sind klein.
- Sie sind frei durchgängig, permeabel an biologische Membranen. Sie besitzen endokrine, parakrine und autokrine Wirkungen. In ihrer endokrinen Wirkungsweise können etwa Gasotransmitter aus Geweben freigesetzt werden, im Blutstrom verbreitet und dann modulierende Funktionen auf entfernte Zielzellen entfalten.
- Sie werden endogen und enzymatisch erzeugt und ihre Produktion ist geregelt.
- Sie sind chemisch definiert und besitzen spezifische Funktionen in physiologisch relevanten Konzentrationen. Somit rufen sie in endogenen Konzentrationen spezifische physiologische Veränderungen hervor.
- Ihre physiologischen und zellularen Funktionen können durch exogen applizierte Moleküle nachgeahmt werden.[1]
Biologische Synthese und Wirkung des Stickstoffmonoxids (NO)
NO entsteht enzymatisch durch die Wirkung der verschiedenen NO-Synthasen (NOS so NOS-I, NOS-II und NOS-III) aus der Aminosäure L-Arginin.
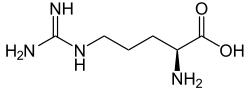
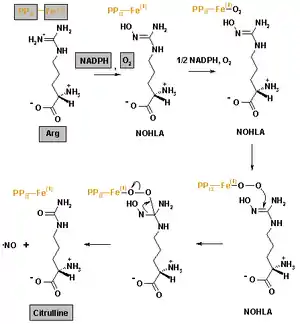
Das kleine Molekül NO ist chemische hoch reaktiv und damit für die biochemischen Strukturen von Zellen destabilisierend. Das macht aus evolutionären Gesichtspunkten eine präzise Regulation der NO-Produktion sinnvoll. Zwei wesentliche Prinzipien des NO-Wirkmechanismus sind beschrieben:
- NO wirkt auf Metalloproteine, genauer auf Metallionen im Zentrum dieser Proteine, z. B. von Enzymen, und erhöht oder vermindert deren Aktivität,
- NO bewirkt eine Protein-Nitrosylierung, dabei wird das NO-Molekül an eine -SH- oder –S–CH3-Gruppe an deren Schwefelatom gebunden. Dies löst eine Konformations- und in deren Folge eine Funktionsänderung am Protein aus.
Freigesetztes NO wirkt intrazellular über die Aktivierung der löslichen Guanylylcyclasen und in deren Folge mit einer Zunahme an intrazellulärer Produktion des second messengers Cyclisches Guanosinmonophosphat (cGMP).[8]
Biologische Synthese und Wirkung des Kohlenmonoxids (CO)
Im Organismus wird das CO-Molekül zu etwa 86 % durch den oxidativen Abbau aus dem Häm-Molekül unter gleichzeitiger Freisetzung von Eisen (Fe2+ bzw. dann zu Ferritin) und Biliverdin gebildet.
Häm b + 3O2 + 3½NADPH + 3½H+ + 7e- → Biliverdin + Fe2+ + CO + 3½NADP+ + 3H2O
Nur 14 % des endogenen CO stammen aus der Photooxidation, Lipidperoxidation und von Bakterien.
Das Häm-abbauende Enzym Hämoxygenase findet sich in fast allen tierischen Geweben, bei Vertebraten hauptsächlich in der Milz. Nach jetzigem Forschungsstand sind drei Isoformen bekannt, davon zwei beim Menschen.
- Das induzierbare HO-1 (auch als Hitzeschockprotein 32 bezeichnet) kann mittels verschiedener Stoffe hochreguliert werden; diese sind etwa das Häm-Molekül (Positive Rückkopplung), verschiedene Schwermetalle, Wachstumsfaktoren, das NO-Molekül, verschiedene Lipide, im Rahmen einer Hypoxie.
- Das konstitutive HO-2 in den verschiedensten Organen bzw. Geweben dieser Organe, etwa dem zentralen Nervensystem, Endothel und den Testes.
Auch das CO-Molekül kann die lösliche Guanylatcyclase aktivieren und durch eine gesteigerte Produktion des intrazellulären cGMP seine intrazellulären Effekte auslösen.[10] Das CO-Molekül beeinflusst die cGMP aber in geringerem Maße als es das NO-Molekül vermag, so beträgt die Aktivierung durch CO nur Faktor 4–5; im Vergleich hierzu bewirkt NO eine 200-fache Aktivierung.
Biologische Synthese des Schwefelwasserstoffs (H2S)
Schwefelwasserstoff wird in den Zellen aus der Aminosäure L-Cystein durch die Wirkung der Enzyme Cystathionin-γ-Lyase (CSE) (EC 4.4.1.1) oder der Cystathionin-β-Synthase (CBS) synthetisiert.
Cystein + H2O → Serin + H2S
Das Gas, einmal freigesetzt, reagiert rasch mit Thiolresten aus der in der Umgebung befindlichen Proteinen (-Cys wird zu -CySSH) und verändert dadurch deren biologische Aktivität (Konformationsänderung). Insbesondere das Enzym Cytochrom-c-Oxidase wird dadurch deaktiviert. Der Großteil wird jedoch in den Mitochondrien über Thiosulfat und Sulfit zu Sulfat oxidiert, oder über Cysteinsulfinat zu Sulfit/Sulfat oder Taurin prozessiert.[11] Enzyme die zur H2S-Produktion in der Lage sind werden in verschiedenen Gewebetypen bzw. Organen gefunden, so im Blutgefäßsystems, in der Leber, in den Nieren und im Gehirn. In letzterem Organ werden zudem die höchsten H2S-Konzentrationen gefunden.
Literatur
- Ashley A. Untereiner, Lingyun Wu, Rui Wang: The Role of Carbon Monoxide as a Gasotransmitter in Cardiovascular and Metabolic Regulation. (PDF) In: A. Hermann u. a. (Hrsg.): Gasotransmitters: Physiology and Pathophysiology. Springer-Verlag, Berlin/ Heidelberg 2012, ISBN 978-3-642-30338-8, S. 37–70.
- C. Ori, F. Ford-Rice, E.D. London: Effects of nitrous oxide and halothane on μ- and κ-opioid receptors in guinea-pig brain. In: Anesthesiology. 70, 1989, S. 541–544.
- M. A. Gillman: Nitrous oxide as neurotransmitter. In: Lancet. 339, 1992, S. 307.
- M. A. Gillman: Nitrous oxide, Nitric oxide and neurotransmission. In: Brit Med J. 305, 1992, S. 1368.
- M. A. Gillman, F.J. Lichtigfeld: NO comments. In: Nature. 367, 1994, S. 28.
- M. A. Gillman: Discovery of gasotransmission. In: The Scientist. 18 (2004)
- J. Hyun, G. Chaudhuri, J. M. Fakuto: The reductive metabolism of nitric oxide in hepatocytes: possible interaction with thiols. In: Dru. Metab Dispos. 27, 1999, S. 1005–1009.
- O. Einarsdottir, W. S. Caughey: Interactions of the anesthetic N2O with bovine heart cytochrome c oxidase. In: J Biol Chem. 263, 1988, S. 9199–9205.
- R. Wang (Hrsg.): Signal Transduction and the Gasotransmitters: NO, CO and H2S in Biology and Medicine. Humana Press, New Jersey, USA (2004)
- R. Wang: Two’s company, three’s a crowd - Can H2S be the third endogenous gaseous transmitter? In: FASEB Journal. 16, 2002, S. 1792–1798.
- J. P. Cooke: The 1998 Nobel prize in Medicine: clinical implications for 1999 and beyond. In: Vascular Medicine. 4, 1999, S. 57–60.
- J. Garthwaite: Concepts of neural nitric oxide-mediated transmission. In: European Journal of Neuroscience. 27, 2008, S. 2783–2802.
- A. Papapetropoulos, A. Pyriochou, Z. Altaany, G. Yang, A. Marazioti, Z. Zhou, M. G. Jeschke, L. K. Branski, D. N. Herndon, R. Wang, C. Szabó: Hydrogen sulfide is an endogenous stimulator of angiogenesis. In: PNAS. 2009.
- Friedrich Marks, Ursula Klingmüller, Karin Müller-Decker: Cellular Signal Processing. An Introduction to the Molecular Mechanisms of Signal Transduction. Taylor & Francis, Garland Science 2009, ISBN 978-0-8153-4215-1, S. 580–585.
- Julia Steidle: Wirkungen des Gasotransmitters Kohlenmonoxid auf den Ionentransport am Kolon der Ratte. (PDF; 5,7 MB) Inaugural-Dissertation. Fachbereich Veterinärmedizin der Justus-Liebig-Universität Gießen. VVB Laufersweiler Verlag, Giessen 2011.
- A. Hermann u. a.: Gase als zelluläre Signalstoffe. Gasotransmitter. (PDF; 1,5 MB). Biologie in unserer Zeit, 2010, 40, S. 185–193. doi:10.1002/biuz.201010422
Weblinks
- gasotransmitters.eu – European Network on Gasotransmitters (ENOG), offizielle Web-Seite
- Verena Engelke, Adina Rocher, Peter Imming: Gasotransmitter. Paradoxon Kohlenmonoxid. In: Pharmazeutische Zeitung online, 33/2010, online 2012
- Gasotransmitter: flüchtige Überträgerstoffe. SpringerMedizin.at, 19. Oktober 2010
Einzelnachweise
- Anton Hermann, Guzel F. Sitdikova, Thomas M. Weiger: Gase als zelluläre Signalstoffe. Gasotransmitter. In: Biologie in unserer Zeit. 40, 2010, S. 185–193, doi:10.1002/biuz.201010422.
- M. A.,Gillman, F. J. Lichtigfeld: A comparison of the effects of morphine sulphate and nitrous oxide analgesia on chronic pain states in man. In: J. Neurol. Sci. 49 (1), 1981, S. 41–45. doi:10.1016/0022-510X(81)90186-6. PMID 7205318.
- M. A. Gillman, F. J. Lichtigfeld: The similarity of the action of nitrous oxide and morphine. In: Pain. 10 (1), 1981, S. 110. PMID 7232008.
- M. A. Gillman, F. J. Lichtigfeld: Nitrous oxide interacts with opioid receptors: more evidence. In: Anesthesiology, 58 (5), 1983, S. 483–484. PMID 6301312.
- C. Daras, R. Cantrill, M. A. Gillman: (3H)Naloxone displacement: evidence for nitrous oxide as opioid receptor agonist. In: Eur J Pharmacol., 89, S. 177–178.
- R. Wang: Two’s company, three’s a crowd – Can H2S be the third endogenous gaseous transmitter? In: FASEB Journal, 16, 2002, S. 1792–1798.
- R. Wang (Hrsg.): Signal Transduction and the Gasotransmitters: NO, CO and H2S in Biology and Medicine. Humana Press, New Jersey 2004.
- R. G. Knowles, S. Moncada: Nitric oxide synthases in mammals. In: Biochem J. 298, 1994, S. 249–258.
- Verena Engelke, Adina Rocher, Peter Imming: Gasotransmitter. Paradoxon Kohlenmonoxid. In: Pharmazeutische-Zeitung, 33/2010; pharmazeutische-zeitung.de
- S. J. Gibbons, G. Farrugia: The role of carbon monoxide in the gastrointestinal tract. In: J Physiol., 556, 2004, S. 325–336.
- M. H. Stipanuk, I. Ueki: Dealing with methionine/homocysteine sulfur: cysteine metabolism to taurine and inorganic sulfur. In: Journal of inherited metabolic disease. Band 34, Nummer 1, Februar 2011, S. 17–32. doi:10.1007/s10545-009-9006-9. PMID 20162368. PMC 290177 (freier Volltext).
