Luftatmung bei Knochenfischen
Luftatmung bei Knochenfischen ist die Aufnahme atmosphärischer Luft durch Knochenfische (Osteichthyes).[1][2][3][4] Alle Knochenfische besitzen Kiemen zur Atmung in Wasser. Luftatmung entwickelten mindestens 60 getrennte Linien der Knochenfische.[2][3] Die Luftatmung kann die Kiemenatmung unterstützen oder zeitweise ersetzen.[4] Sie kann obligat (zwingend) oder fakultativ (wahlweise) ausgeübt werden.[4] Bei einigen Fischen kann die Luftatmung auf bestimmte Lebensabschnitte (Larvenstadium – Juvenilform – Adultform) beschränkt sein.[5] Einige Gruppen besitzen sogar drei Atemsysteme: Kiemen, Hautatmung und Luftatmung über ein spezielles Organ.


Fischgruppen
Die Mehrzahl der Fische mit Möglichkeit der Luftatmung sind Süßwasserfische der Tropen oder der Flussmündungen.[4] Die meisten luftatmenden Fische gehören heute zu den Echten Knochenfischen (Teleostei). Weitere luftatmende Fische sind die Lungenfische (Dipnoi), die Flösselhechte (Polypteriformes) und die Knochenganoiden (Holostei).[4] Eine kleinere Anzahl luftatmender Fische lebt in gemäßigten Zonen. Einige, wie der Kahlhecht (Alma calva), leben in Gewässern, die saisonal zufrieren.[4]
Berichte über luftatmende Knorpelfische beruhen auf unbestätigten Beobachtungen an Plattenkiemern (Elasmobranchii).[4]
Sauerstoff und Wasser
Wasser ist im Vergleich zu Luft sauerstoffarm. Die Luft in Meereshöhe enthält etwa 30-mal soviel Sauerstoff (O2) wie vollständig mit Sauerstoff gesättigtes Wasser.[2] Jedoch liegt der Sauerstoffgehalt des Wassers immer unterhalb dieses Sättigungswertes, er kann sogar erheblich darunter liegen. Fische mit zwei alternativen Atmungssystemen besitzen in sauerstoffarmem Wasser entsprechend eine verbesserte Möglichkeit der Sauerstoffaufnahme gegenüber anderen.

Mit der Luftatmung entfällt der Energiebedarf durch die Kiemenventilation, die in sauerstoffarmem Wasser z. B. beim Karpfen 13–22 % der Gesamtenergie verzehren kann und mit zunehmender Sauerstoffverknappung problematisch wird.[2] So verbraucht Oreochromis niloticus in sauerstoffreichem Wasser nur 3 % der Energie für die Kiemenventilation, bei Sauerstoffmangel (PO2 unter 35 mmHg (≈0,047 Bar)) kann dieser Energieaufwand auf 20 % steigen.[2]
Der Gebrauch der Luftatmung steigt mit zunehmender Aktivität bzw. mit verminderter Verfügbarkeit von Sauerstoff im Wasser und erhöhter Wassertemperatur.[2] Einige zur Luftatmung befähigte Knochenfische adaptierten sich auch an hypoxe Wasserbedingungen mit erhöhtem Schwefelwasserstoffgehalt.
Hoplosternum littorale hält seine Sauerstoffaufnahme relativ konstant bis zu einem unteren Sauerstoffpartialdruck von 50 mmHg, bei einer Luftatemfrequenz von etwa einem Atemzug pro Stunde. Zwischen 40 und 50 mmHg wird Hoplosternum littorale von Luftatmung abhängig und bei 10 mmHg benötigt er viereinhalb Atemzüge in der Stunde. Für ihn wird Schwefelwasserstoff ab einer Konzentration von 70 µM (Mikromol) akut lebensbedrohend, wenn gleichzeitig genug Sauerstoff zur Verfügung steht, bei Sauerstoffarmut und gleichzeitiger Luftatmung wird Schwefelwasserstoff aber erst ab einer Konzentration von 87 µM lebensbedrohend giftig.[6]
Kiemen
Alle Knochenfische besitzen funktionierende Kiemen.
Obligat luftatmende Fische sterben selbst in sauerstoffreichem Wasser, wenn ihnen der Zugang zur Oberfläche verwehrt wird, denn ihre Kiemen sind unterdimensioniert, um ausreichend Sauerstoff zu gewinnen.[4]
Fische, die keine Luftatmung besitzen, sind häufig dazu befähigt, unter hypoxen Bedingungen das sauerstoffreiche Oberflächenwasser über ihre Kiemen zu nutzen. Bei einer Untersuchung von 68 Arten aus Panama zeigten 93 % der Süßwasserfische und 72 % der marinen Fische ein solches Verhalten, aber nur 42 % der Arten, die in normalerweise sauerstoffreichen Meeresgewässern leben.[7]

Nicht alle Fische, die hypoxe Wasserräume besiedeln können, sind zur Luftatmung befähigt. So kann Traíra (Hoplias malabaricus) nur über Kiemen atmen (obgleich Arten der gleichen Familie Raubsalmler wie Hoplerythrinus unitaeniatus oder Blauer Raubsalmler Erythrinus erythrinus obligate Luftatmer sind). Trotzdem hält Traíra bei Sauerstoffpartialdrucken zwischen 150 und 25 mmHg nach Anpassung seine Sauerstoffaufnahme weitgehend konstant, auch wenn er an eine andere Sauerstoffsättigung angepasst ist. Angepasst an normal sauerstoffreiches Wasser zeigt Traíra aber in sauerstoffarmem Wasser mit Sauerstoffpartialdruck von 10 mmHg Symptome eines Hypoxie-Komas, welches bei Fischen, die bereits an sauerstoffarmes Wasser angepasst sind, erst ab 5 mm Hg Sauerstoffpartialdruck auftritt (die Anpassungszeit für hypoxe Bedingungen beträgt dabei z. B. 14 Tage bei einem Sauerstoffpartialdruck von 25 mmHg).[8]
Luftatmungsorgane
Aufgrund der vielfältigen analogen Entwicklungswege bedienen sich verschiedene Knochenfische ganz unterschiedlicher Organsysteme zur Ausübung der Luftatmung.[9] Luftatmende Fische besitzen meist ein Hohlorgan zur Aufnahme und Resorption der Luft; dabei kann es sich um Teile eines umgewandeltes Organs handeln oder um eine evolutionäre Neubildung.[4] Es ist reich mit Gefäßen ausgestattet, die feine Kapillaren oder ein Lakunensystem in den begrenzenden Membranen des Hohlorgans versorgen.[4] Hier sind auch grenzflächenaktive Substanzen, sog. Surfactants, die auch in Kiemen und Lungen an den Grenzflächen vorkommen.[2][10] Häufig luftatmende Fische besitzen auch eine Muskulatur, die rhythmische Kontraktionen für einen mehrmaligen Luftaustausch erlaubt.[4] Fast keiner der Blutkreisläufe luftatmender Fische ist für die Zuführung sauerstoffarmen Blutes an das Luftatmungsorgan optimiert: die aus dem Körper kommenden Gefäße tragen noch etwa zur Hälfte sauerstoffreiches Blut, außer bei Lungenfischen (Dipnoi).[11]
Lungen
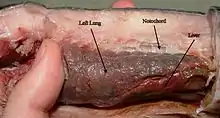

Bei Lungenfischen (Dipnoi) und Flösselhechten (Polypteridae) entwickelten sich echte Lungen.[2][11]
Die Luftatmung der Lungenfische ist effektiver als die anderer Knochenfische. Dies hängt auch damit zusammen, dass sie die einzigen Knochenfische sind, deren Blutkreislauf sowohl auf die Kiemenatmung wie auf die Lungenatmung optimiert ist, indem jedem der beiden äußeren Atmungsorgane besonders sauerstoffarmes Blut zugeführt wird, womit eine hohe Sauerstoffanreicherung ermöglicht wird:[11] Der Australische Lungenfisch (die einzige rezente Art der Ordnung Ceratodontiformes) besitzt einen Lungenkreislauf mit geteilten Vorkammern, vertikalem Loch in der Herzscheidewand, Lungenvenen, Conus Ventrikel und langer Spiralfalte im Conus arteriosus (siehe auch Herz der Knochenfische).[11]
Auch Lepidosireniformes wie die afrikanischen Lungenfische (Protopterus) und südamerikanischen Lungenfische (Lepidosiren) entwickelten einen ähnlichen Lungenkreislauf mit paarigen Lungen, verminderten vorderen Kiemenbögen und gutentwickelter Spiralfalte im Conus arteriosus.[11]
Schwimmblase
Daneben entwickelten sich mehrfach Luftatmungsorgane aus der Schwimmblase, so bei den Knochenhechten (Lepisosteidae), z. B. bei Lepisosteus und beim Kahlhecht (Amia calva).[2][4]
Verdauungstrakt
Bei Hypostomus (Loricariidae) entstand das Luftatmungsorgan aus dem Verdauungstrakt.[2] Die Magenwände von Hypostomus plecostomus sind im Vergleich mit anderen Knochenfischen sehr viel dünner, transparent und faltenlos.[12]
Suprabranchialorgan
Die adulten Labyrinthici (Labyrinthfische (Anabantoidei) und Schlangenkopffische (Channoidei)) besitzen ein Suprabranchialorgan.[13] Es besteht aus dem verbreiterten Epibranchiale I oder Labyrinth, das sind paarig im Schädel über den Kiemenkammern liegende Höhlungen, die mit ihnen in Verbindung stehen.[13] Sie sind reichlich von stark durchbluteten Epithelien ausgekleidet.[13][14] In diese Höhlungen wird mit dem Maul aufgenommene Luft eingepresst.[13] Diese Epithelauskleidungen werden über die erste und zweite Kiemenbogenarterie aus dem vorderen Ast der vom Herzen abgehenden zweigeteilten Aorta versorgt.[13] Der durch die Epithelien resorbierte Sauerstoff wird nicht über die Dorsalaorta, sondern über die Vena cardinalis anterior abgeführt.[13]
Die Funktion des Organs wurde auch als akustischer Resonanzverstärker gedeutet, da z. B. beim Zwergfadenfisch (Colisa lalia) keine für eine Atmung typischen Luftdruckschwankungen beobachtet werden konnten.[15] Die Vorstellung, dass einige der auskleidenden Schleimhautzellen aus Kiemenzellen hervorgingen, wurde für den Kletterfisch (Anabas testudineus) widerlegt, es handelt sich vielmehr um Analogentwicklungen.[9]
Pharynxkammern
Bei Amphipnous cuchia (ein Kiemenschlitzaal) sind Atmungshöhlungen im Kopf als Anhang des Pharynx ausgebildet.[9]
Kiemendeckelkammern

Bei Schlammspringern wie Periophthalmus vulgaris und Schlammspringerverwandten (Oxudercinae) wie Boleophthalmus boddaereti wurden Kiemendeckelkammern (Operculum) in zusätzliche Atemhöhlen umgewandelt.[9] Bei Periophthalmus vulgaris sind sie besonders groß ausgebildet und reichlich mit Gefäßen zur Atmung versorgt.[9] Komplexe getrennte Ventile regulieren Einstrom und Auslass für diese Atemkammern.[9]
Hautatmung
Über (feucht gehaltene und gut durchblutete) Schleimhäute ist eine Hautatmung sowohl im Wasser wie in Luft möglich. Die Effizienz an Land kann aufgrund des höheren Sauerstoffpartialdruckes höher sein. Diese Fische sind meist durch eine nicht vollständige Beschuppung gekennzeichnet. Hautatmung praktizieren z. B. der Atlantische Butterfisch (Pholis gunnellus), Kabeljau (Gadus morhua), die Fünfbärtelige Seequappe (Ciliata mustela), einige Schleimfische (z. B. Blennius pholis), Flunder (Platichthys flesus), Seezunge (Solea solea) und Aal (Anguilla anguilla).[16] Beim Atlantischen Butterfisch, Kabeljau und Fünfbärteliger Seequappe ist die Hautatmung nicht sehr leistungsfähig und reicht nur zur Versorgung der Hautbereiche selbst,[16] entlastet damit aber Kreislauf und Kiemenatmung. Bei der Seezunge ist hauptsächlich die Unterseite atmungsaktiv.[16]
Luftatmung über Kiemen
Selbst die Kiemen mancher Fische können genutzt werden, um atmosphärischen Sauerstoff aufzunehmen: Der Kiemenschlitzaal Synbranchus marmoratus kann Luft mit dem Maul aufnehmen, und innerhalb 12–15 Minuten resorbieren dessen Kiemen etwa 50 % des enthaltenen Sauerstoffs. Während der Kiemenatmung in Wasser erreicht die Sauerstoffsättigung in seinen Arterien nie mehr als 50–60 %. Nach Luftaufnahme erreicht er aber regelmäßig eine fast vollständige Sauerstoffsättigung im Blut. Dabei steigt auch die Kohlendioxidkonzentration (PCO2) im Blut, allerdings nur kurzfristig, denn das Kohlendioxid wird sehr rasch über die Kiemen abgegeben, sobald die Kiemenkammern wieder von Wasser durchspült werden.[17]
Anpassungen für Landgänge
Bei Landgängen oder unfreiwilliger Trockenheit werden die Kiemen bei Austrocknung funktionslos, nur die Luftatmung kann den Sauerstoffbedarf decken. Parallel mit der Luftatmung können weitere physiologische Anpassungen an die Lebensmöglichkeiten außerhalb des Wassers stehen: für die Fortbewegung an Land, Feuchthaltung des Körpers, Exkretion über Schleimhäute.
Kohlendioxidabgabe
Eine Atemfunktion ist die Sauerstoffaufnahme, eine andere die Kohlendioxidabgabe (CO₂). Unter Luftatmung bei Knochenfischen wird aber primär die kurzfristige Aufnahme sauerstoffhaltiger Luft verstanden. Die Kohlendioxidabgabe über die Kiemen ist prinzipiell erheblich leichter als die Sauerstoffaufnahme aus dem Wasser und daher in der Regel kein Problem.[18] Bei kurzem Luftschnappen unterbleibt daher in aller Regel eine Kohlendioxidabgabe, dadurch kann die Kohlendioxidkonzentration im Blut ansteigen.[17] Mit den Kiemen kann dieses Kohlendioxid im Wasser gut abgegeben werden.[18] Aber spätestens an Land müssen andere Mechanismen als die Kiemen dafür Sorge tragen, dass Kohlendioxid abgegeben wird. Dann erfolgt die Kohlendioxidabgabe meist über die Haut.[18]
Feuchthaltung
Der Kiemenschlitzaal Synbranchus marmoratus ist außerordentlich widerstandsfähig gegenüber Trockenperioden, er kann mehrere Monate außerhalb des Wassers überleben.[17]
Luftatmende Fische wie Kletterfisch, Aale, Heteropneustes und Channa (ein Schlangenkopffisch) können lange Zeiten außerhalb des Wassers verbringen, solange sie nicht austrocknen.[19][20] Der Wasserverlust ist der limitierende Faktor für diese gut an die Luftatmung angepassten Knochenfische.[19] Aale wie Anguilla bengalensis können außerhalb des Wassers sogar bei Trockenheit (bei einer relativen Luftfeuchte von 35–40 %) 3–5 Stunden überleben, wobei sie 20–23 % ihres Körpergewichtes einbüßen.[19]
Soweit über Schleimhäute Harnstoff ausgeschieden wird, trägt er seinerseits zur Feuchthaltung bei, indem er Luftfeuchtigkeit bindet.
Exkretion
Außerhalb des Wassers werden trockene Kiemen funktionslos und die Abgabe giftiger Stoffwechselprodukte, Stickstoffträger, Salze und Ionen zur Entgiftung, Osmoregulation oder Ausgleich des Säure-Basen-Haushaltes über die Kiemen werden durch alternative Exkretionswege ersetzt.
Die meisten Knochenfische geben im Wasser als Stickstoffträger Ammoniak über ihre Kiemen ab.
Nur wenige Fische besitzen alternativ den Harnstoffzyklus und können in geringer Menge über ihre Kiemen oder Schleimhäute auch Harnstoff abgeben. Dazu gehören der Seeteufel (Lophius piscatorius),[21] der Kabeljau (Gadus morhua),[21] der Kugelfisch Sphoeroides maculatus,[21] Aale wie Anguilla rostrata,[21] der Karpfen (Cyprinus carpio),[21] der Kletterfisch (Anabas testudineus),[22] Sicyases sanguineus (ein Schildfisch),[23] der Asiatische kleine Schlangenkopf (Channa gachua),[22] Blennius pholis (ein Schleimfisch),[24] Mystus vittatus (ein Stachelwels),[22] Tilapiaarten aus dem Magadisee[25] und andere, die sich amphibisch in der Gezeitenzone aufhalten. Solange sie von ausreichend Wasser umgeben sind, geben sie Stickstoff wie die meisten Fische hauptsächlich über ihre Kiemen in Form von Ammoniak ab. Sind sie nicht mehr im Wasser, geben viele der dazu befähigten primär Harnstoff über ihre Schleimhäute ab.[22] Bei manchen Fischen entscheiden weniger Umweltbedingungen, als vielmehr das Entwicklungsstadium die Wahl des Stickstoffträgers: Wie die meisten Fische sind auch adulte Regenbogenforellen nicht zur Harnstoffabgabe befähigt, im Gegensatz dazu können juvenile Regenbogenforellen vier der zur Harnstoffproduktion erforderlichen Enzyme herstellen.[25]
Knochenfische mit Hautatmung können oft über ihre Schleimhaut auch andere Stoffe aufnehmen und abgeben. Wie viele andere auch, nimmt der Kiemenschlitzaal Symbranchus marmoratus auch Ionen zu seiner Osmoregulation, zur Regulierung seines Säure-Basen-Verhältnisses und zur Stickstoffausscheidung auf bzw. gibt sie ab. Bei Symbranchus marmoratus überwiegt der Weg über die Haut aber den Weg über die Kiemen, seine Haut kann als Ionen-Transport-Organ betrachtet werden.[26][27]
Fortbewegung

Der Kletterfisch (Anabas testudineus) bewegt sich namensgebend an Land geschickt fort. Mit seiner Schwanzflosse stößt er sich am Untergrund ab und krallt sich mit den Dornfortsätzen seiner Kiemendeckel in Unebenheiten. Ungewöhnlich für einen Knochenfisch, sind seine Kiemendeckelknochen nicht zu einem festen Operculum verbunden, sondern gegeneinander beweglich. Ermüdet oder abgestürzt, kann sich der Kletterfisch auch seitlich liegend mit der Schwanzflosse vorwärts schieben, wobei sich ein Kiemendeckeldorn unterstützend in den Untergrund bohren kann. Die Maximalgeschwindigkeit liegt bei 1,8 Körperlängen in der Sekunde, die Maximalsteigung bei 30° auf Wiese, er kann Hindernisse von mindestens seiner halben Körperlänge senkrecht überwinden, aber kaum Holzgewächse erklimmen.[28]
Eine besonders effektive Art der Fortbewegung an Land praktizieren Schlammspringer (Periophthalmus) und Schlammspringerverwandte, was für sie namensgebend wurde. Periophthalmus können auch höher gelegene Areale erreichen und sogar Mangrovenwurzeln erklettern. Dabei übertragen die Brustflossen die Sprungkraft.[29]
Aale wie der europäische Aal (Anguilla anguilla) haben an Land ihre schlangenähnliche Fortbewegungsart beibehalten, die sie auch im Wasser anwenden. Die Arbeit wird dabei von den Längsmuskeln geleistet. Die Muskelleistung und erzielte Geschwindigkeit in Wasser ist höher als an Land, was damit erklärt wird, dass die Haftung der geringen Auflagefläche an Land bei diesem Bewegungsablauf keine höhere Geschwindigkeit zulässt.[30]
Verhalten an Land
So unterschiedlich die anatomisch-physiologischen Anpassungen sind, die Landgänge ermöglichen, so verschiedenartig sind auch die dadurch sich eröffnenden Vorteile und Lebensweisen der damit ausgestatteten Knochenfischgruppen.
Ernährung
Die meisten Schlammspringerverwandten nehmen bei ihren Landgängen pflanzliche Nahrung auf, Schlammspringer (Periophthalmus) jagen auch Insekten und kleine Krebstiere zu ihrer Ernährung.
Migration
Verschiedene luftatmende Fische wie Kletterfisch, Aale, Kiemenschlauchwelse (Heteropneustes) und Channa (asiatische Schlangenkopffische) wandern durch Grasland von einem Gewässer zu einem anderen.[19][31] Der Kletterfisch soll während Regenzeiten von einem Gewässer zu einem anderen wandern, um dort zu laichen.[19][32]
Evolution
Akzessorische Atmung
Der wichtigste Selektionsdruck für die mehrfache Parallelentwicklung einer die Kiemenatmung unterstützenden Luftatmung bei Knochenfischen entstammt der Sauerstoffarmut im Lebensraum.[4][33] Luftatmende Knochenfische erschienen im späten Silur oder frühen Devon.[9] Es wird angenommen, dass sie sich als Anpassungen an hypoxe Bedingungen entwickelt hatten[9][18] und dass sich daraus letztlich die Lungenatmung der Landwirbeltiere entwickelte.[34]
Der Harnstoffsyntheseweg entwickelte sich bei Knochenfischen möglicherweise, um Ammoniak unter alkalischen Wasserbedingungen (< pH 9,0–9,5) zu entgiften.[25]
Die Schwimmblase wurde aus einer unpaarigen dorsalen Ausstülpung des Vorderdarms (Pharynx) der Knochenfische gebildet.[35] Sie stellt eine Weiterentwicklung der primären Fischlunge dar mit einem Funktionswandel von einem Atmungsorgan zu einem hydrostatischen Organ.[36] Diese hat sich sekundär bei einigen luftatmenden Knochenfischen wieder zu einem Atemorgan entwickelt.
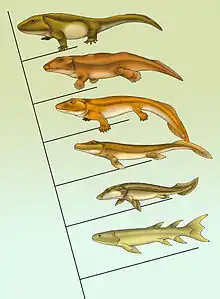
Eusthenopteron, Panderichthys, Tiktaalik, Acanthostega, Ichthyostega, Pederpes
Landgang
Es wurde die Vermutung geäußert, dass die Lungen der Landwirbeltiere homolog der Schwimmblase seien.[34] Dem widersprechen andere Befunde, die eine Homologie der Lungen der Lungenfische (Dipnoi), der Flösselhechte (Polypteriformes) und der Landwirbeltiere nahelegen, welchen gegenüber die Schwimmblase ein analoges Organ darstellt.[35] Die Lungen der Lungenfische und Flösselhechte gingen aus paarigen Ausstülpungen des Schlundes (Pharynx) hinter der Kiemenkammer hervor.[35] Die versorgenden Gefäße entsprechen Arterie und Vene des sechsten Kiemenbogens.[35] Aber trotz vielfältiger Befunde sind die Homologiebeziehungen zwischen Schwimmblase, Lungen der Knochenfische, Lungen der Landwirbeltiere und anderer Luftatmungssysteme der Knochenfische nicht zweifelsfrei geklärt, denn jeder Erklärungsversuch steht vor dem einen oder anderen Widerspruch und die Abfolge einiger Entwicklungsschritte ist unklar.[35]
Das Kreislaufsystem des Australischen Lungenfischs (Neoceratodontidae) mit echtem Lungenkreislauf ist den Kreislaufsystemen der Landwirbeltiere homolog.[11]
Die Entwicklung der Landwirbeltiere verlief über einen noch unbekannten Vorfahren innerhalb der Knochenfische mit Lungen[35] und wahrscheinlich bereits vierfüßiger (quadrupeder) Fortbewegung.[37] Insofern stellen die Knochenfische keine monophyletische Gruppe dar. Die Hautatmung der Amphibien kann sekundär entwickelt worden sein und muss nicht der Hautatmung eines Knochenfischvorfahren homolog sein.[37] Die rezenten Amphibien erlauben wenig Rückschlüsse auf die physiologisch-anatomische Ausstattung der frühen Formen.[37] Durch Fossilien sind eine Reihe Zwischenformen des „Landgangs“ aus dem Devon gut dokumentiert.[38][39][40][41]
Einzelbelege
- Kurt Fiedler: Luftatmung bei Knochenfischen. In: Kurt Fiedler (Hrsg.): Lehrbuch der Speziellen Zoologie. Band II, Teil 2: Fische. Gustav Fischer Verlag, Jena 1991, ISBN 3-334-00339-6.
- M. L. Glass, F. T. Rantin: Gas exchange and control of respiration in air-breathing teleost fish. In: Cardio-Respiratory Control in Vertebrates. Springer, Berlin/Heidelberg 2009, ISBN 978-3-540-93984-9, S. 99–119. doi:10.1007/978-3-540-93985-6_5
- Jeffrey B. Graham (Hrsg.): Air-breathing fishes: evolution, diversity, and adaptation. Academic Press, 1997, ISBN 0-12-294860-2.
- Kjell Johansen: Air breathing in fishes. In: William Stewart Ioar, David J. Randall (Hrsg.): Fish Physiology. Band 4, Academic Press, 1970, S. 361–411.
- Riaz Ahmad, Absar-ul Hasnain: Ontogenetic changes and developmental adjustments in lactate dehydrogenase isozymes of an obligate air-breathing fish Channa punctatus during deprivation of air access. In: Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, Band 140, Nr. 2, 2005, S. 271–278.
- E. G. Affonso, F. T. Rantin: Respiratory responses of the air-breathing fish> Hoplosternum littorale to hypoxia and hydrogen sulfide. In: Comparative Biochemistry and Physiology – Part C Toxicology & Pharmacology, Band 141, Nr. 3, 2005, S. 275–280.
- Donald L. Kramer: Aquatic surface respiration in the fishes of Panama: distribution in relation to risk of hypoxia. In: Environmental Biology of Fishes, Band 8, Nr. 1, 1983, S. 49–54.
- Francisco Tadeu Rantin, Kjell Johansen: Responses of the teleost Hoplias malabaricus to hypoxia. In: Environmental Biology of Fishes, Band 11, Nr. 3, 1984, S. 221–228.
- Hiran M. Dutta, J. S. Datta Munshi: Functional morphology of air-breathing fishes: A review. In: Proceedings: Animal Sciences, Band 94, Nr. 4, 1985, S. 359–375.
- C. F. Phleger, B. S. Saunders: Swim-bladder surfactants of Amazon air-breathing fishes. In: Canadian Journal of Zoology, Band 56, Nr. 4, 1978, S. 946–952.
- Warren W. Burggren, Kjell Johansen: Circulation and respiration in lungfishes (Dipnoi). In: Journal of Morphology, Band 190, Nr. S1, 1986, S. 217–236. doi:10.1002/jmor.1051900415
- Dagmara Podkowa, Lucyna Goniakowska‐Witalińska: Morphology of the air‐breathing stomach of the catfish Hypostomus plecostomus. In: Journal of Morphology, Band 257, Nr. 2, 2003, S. 147–163, doi:10.1002/jmor.10102.
- Wilfried Westheide, Gunde Rieger: Labyrinthici (Anabantoidei und Channoidei). In: Wilfried Westheide, Gunde Rieger (Hrsgb.): Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere, Teil 2, Life Sciences, Springer, 2010, Kapitel 5.15.4.14, S. 305
- W. Westheide, G. Rieger (Hrsg.): Spezielle Zoologie. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0307-3
- Stefan Schuster: The volume of air within the swimbladder and breathing cavities of the anabantoid fish Colisa laua (Perciformes, Belonthdae). In: Journal of Experimental Biology, Band 144, Nr. 1, 1989, S. 185–198.
- G. Nonnotte, R. Kirsch: Cutaneous respiration in seven sea-water teleosts. In: Respiration Physiology, Band 35, Nr. 2, 1978, S. 111–118.
- Kjell Johansen: Air breathing in the teleost Symbranchus marmoratus. In: Comparative Biochemistry and Physiology, Band 18, Nr. 2, 1966, S. 383–395.
- Gordon R. Ultsch: The potential role of hypercarbia in the transition from water-breathing to air-breathing in vertebrates. In: Evolution, Band 41, Nr. 2, 1987, S. 442–445. doi:10.2307/2409152
- D. Mallikaraj et al.: The survival out of water and evaporative water loss in Anguilla bengalensis related to relative humidity. In: International Journal of Pharmaceutical & Biological Archive, Band 2, Nr. 2, 2011.
- S. L. Hora: Physiology, bionomics and evolution of the air-breathing fishes of India. In: Trans. Nat. Inst. Sci., India, Band 1, S. 1–16.
- Homer W. Smith: The excretion of ammonia and urea by the gills of fish. In: Journal of Biological Chemistry, Band 81, Nr. 3, 1929, S. 727–742.
- M. Ramaswamy, T. Gopalakrishna Reddy: Ammonia and urea excretion in three species of air-breathing fish subjected to aerial exposure. In: Proceedings: Animal Sciences, Band 92, Nr. 4, 1983, S. 293–297. doi:10.1007/BF03186197
- J. Cancino, J. Castilla: Emersion behaviour and foraging ecology of the common Chilean clingfish Sicyases sanguineus (Pisces: Gobiesocidae). In: Journal of Natural History, Band 22, 1988, S. 249–261.
- J. Davenport, M. D. J. Sayer: Ammonia and urea excretion in the amphibious teleost Blennius pholis (L.) in sea-water and in air. In: Comparative Biochemistry and Physiology Part A: Physiology, Band 84, Nr. 1, 1986, S. 189–194.
- Patricia A. Wright, Michelle D. Land: Urea production and transport in teleost fishes. In: Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, Band 119, Nr. 1, 1998, S. 47–54.
- Norbert Heisler: Intracellular and extracellular acid-base regulation in the tropical fresh-water teleost fish Synbranchus marmoratus in response to the transition from water breathing to air breathing. In: Journal of Experimental Biology, Band 99, Nr. 1, 1982, S. 9–28.
- Daniel F. Stiffler et al.: Cutaneous ion transport in the freshwater teleost Synbranchus marmoratus. In: Physiological Zoology, 1986, S. 406–418.
- J. Davenport, A. K. M. Matin: Terrestrial locomotion in the climbing perch, Anabas testudineus (Bloch)(Anabantidea, Pisces). In: Journal of Fish Biology, Band 37, Nr. 1, 1990, S. 175–184, doi:10.1111/j.1095-8649.1990.tb05938.x.
- Vernon A. Harris: On the locomotion of the mud‐skipper Periophthalmus koelreuteri (Pallas):(Gobiidae). In: Proceedings of the Zoological Society of London, Band 134, Nr. 1, 1960. doi:10.1111/j.1469-7998.1960.tb05921.x
- D. J. Ellerby, I. L. Y. Spierts, J. D. Altringham: Fast muscle function in the European eel (Anguilla anguilla L.) during aquatic and terrestrial locomotion. In: Journal of Experimental Biology, Band 204, Nr. 13, 2001, S. 2231–2238.
- B. K: Das: The bionomics of certain air – breathing fishes of India, together with an account of the development of their air-breathing organs. In: Phli. Trans. Ser. B., Band 216, Nr. 433, 1927, S. 183–219.
- G. M. Natarajan: Studies on the respiration of Anabas scandens (Cuvier). M.Sc. thesis submitted to I.C.A.R., New Delhi, India, 1972.
- Joseph Barrell: The Influence of Silurian-Devonian Climates on the Rise of Air-Breathing Vertebrates. In: Proceedings of the National Academy of Sciences, Band 2, Nr. 8, 1916, S. 499. PMC 1091077 (freier Volltext)
- Colleen Farmer: Did lungs and the intracardiac shunt evolve to oxygenate the heart in vertebrates. In: Paleobiology, Band 23, Nr. 3, 1997, S. 358–372.
- Steven F. Perry et al.: Which came first, the lung or the breath? In: Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, Band 129, Nr. 1, 2001, S. 37–47.
- Freye, Hans-Albrecht: Zoologie, 9. Aufl. Fischer Verlag, Jena 1991, ISBN 3-334-00235-7
- Alfred Sherwood Romer: Skin breathing – Primary or secondary? In: Respiration Physiology, Band 14, Nr. 1, 1972, S. 183–192.
- Till Biskup: Stammesgeschichte der Wirbeltiere I: Fische und Amphibien. (Memento des Originals vom 10. Juli 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Dump vom 11. Dezember 2012, PDF
- Mythen und Evolution. Handreichung für Lehrerinnen und Lehrer mit Arbeitsmaterialien (Memento des Originals vom 23. März 2011 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Universum Bremen, Dump vom 11. Dezember 2012, PDF
- Matthias Glaubrecht: Wie Amphibien einst ans Land gingen. In: Die Welt vom 27. Juni 1997, Dump vom 11. Dezember 2012
- Donald Prothero: What missing link? Reports of huge gaps in the fossil record have been greatly exaggerated. In: New Scientist. Nr. 2645 vom 1. März 2008, S. 35–41. ISSN 0262-4079, Kurzfassung, doi:10.1016/S0262-4079(08)60548-5