Ethyltrifluoracetoacetat
Ethyltrifluoracetoacetat ist eine chemische Verbindung, welche zu den Ethylestern der Acetessigsäure gehört.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
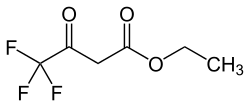 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethyltrifluoracetoacetat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H7F3O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit esterartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,259 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
129–130 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (10 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,375 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Ethyltrifluoracetoacetat kann (wie auch andere 4,4,4-Trihaloacetoacetate) dargestellt werden, in dem in Gegenwart von starken Lewis-Säuren (wie Bortrifluorid) das entsprechende substituierte Säurechlorid zu Ethenon gegeben wird, wobei sich das Acetoacetylchlorid bildet, das dann mit einem Alkohol zu Ethyltrifluoracetoacetat umgesetzt wird.[3]
Es kann auch durch Claisen-Kondensation zwischen Ethyltrifluoracetat und Ethylacetat gewonnen werden.[4]
Verwendung
Ethyltrifluoracetoacetat wird als Zwischenprodukt zur Herstellung heterocyclischer[4] chemischer Verbindungen (zum Beispiel Dithiopyr und Mefloquin) verwendet.[3] Es wird auch zur Herstellung von Trifluormethylketonen durch Caroll-Reaktion eingesetzt.[4] Mit einigen Seltenerdverbindungen bildet es Komplexe.[5]
Einzelnachweise
- Datenblatt Ethyl-4,4,4-trifluoracetoacetat (PDF) bei Merck, abgerufen am 12. Juni 2014.
- Datenblatt Ethyl 4,4,4-trifluoroacetoacetate, 99% bei Sigma-Aldrich, abgerufen am 11. Juni 2014 (PDF).
- Wiley-VCH (Hrsg.): Ullmann's Fine Chemicals. John Wiley & Sons, 2013, ISBN 978-3-527-68357-4, S. 805 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jean-Pierre Bégué, Daniele Bonnet-Delpon: Bioorganic and Medicinal Chemistry of Fluorine - Jean-Pierre Bégué, Daniele Bonnet-Delpon. John Wiley & Sons, 2008, ISBN 0-470-28187-1, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gschneider: Handbook on the Physics and Chemistry of Rare Earths. Elsevier, 2009, S. 221 (eingeschränkte Vorschau in der Google-Buchsuche).

