Fragmentierung (Massenspektrometrie)
Die Fragmentierung von Molekülen entsteht bei der Massenspektrometrie während der Ionisation der zu analysierenden Substanz. Sie kann wie bei der Elektronenstoßionisation gewollt sein, um Daten zur Strukturaufklärung zu gewinnen. Im Folgenden sind die Hauptfragmentierungsreaktionen aufgezählt.
Alpha-Spaltung
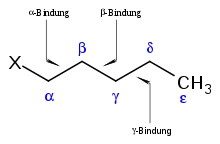
Heteroatome fördern die Spaltung der zu ihnen ständigen alpha-Bindung. Durch einen Elektronenstoß verliert ein Heteroatom ein Elektron aus einem freien, nichtbindenden Elektronenpaar und wird zu einem Radikal. Nach der Ionisation des Heteroatoms bewegt sich ein Elektron aus der sigma-Bindung eines direkt dem Heteroatom benachbarten C-Atoms (dem alpha-C-Atom) zum Heteroatom und bildet zusammen mit dem einzelnen Elektron des Heteroatoms eine Bindung zwischen Alpha-C-Atom und Heteroatom aus. So wird eine zweite Bindung zwischen Heteroatom und C-Atom aufgebaut und das einzelne Elektron des Heteroatoms wird neu gepaart. Infolgedessen wird gleichzeitig die ursprüngliche Bindung des Alpha-C-Atoms gelöst und dessen Bindungspartner wiederum zu einem Radikal.[1]
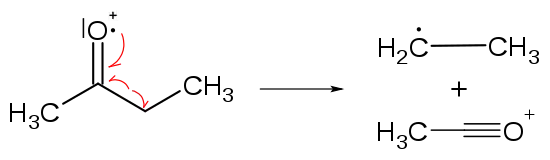
- Dargestellt ist der Verlauf der Alpha-Spaltung. Das einzelne Elektron des Sauerstoff bildet zusammen mit einem Bindungselektron zum Kohlenstoff eine Dreifachbindung aus, die Bindung zum Kohlenstoff wird dabei aufgelöst; die Ethylgruppe (rechts oben) wird zum Radikal (Neuralteilchen).
Verbindungen mit Heteroatomen, die von dieser Regel betroffen sind, sind unter anderem Amine, Alkohole, Ether, Thiole, Sulfide und Halogenide. Dabei ist der zerfallsdirigierende Effekt von
So sind die Fragmente von Aminen im Spektrum außerordentlich intensiv und gut zu erkennen, die Fragmente von Iodiden dagegen nur sehr schwach.[2] Dies hängt mit der Fähigkeit des Heteroatoms zusammen, die positive Ladung zu stabilisieren. Da Heteroatome eine hohe Elektronegativität besitzen, bereitet eine Stabilisierung positiver Ladung gewisse Schwierigkeiten. Daraus resultiert, dass eine homolytische Spaltung am besten durch Heteroatome hervorgerufen werden kann, deren Elektronegativität ähnlich der von Kohlenstoff ist – daraus resultieren die starken Peaks mit Stickstoff, dessen Elektronegativität der von Kohlenstoff am ähnlichsten ist.[3]
Bei mehreren, aufeinander folgenden Fragmentierungsreaktionen findet eine alpha-Spaltung nur einmal statt, da eine homolytische Spaltung in dem kationischen Produkt einer alpha-Spaltung sehr energieaufwändig ist. In der Literatur sind nur wenige Ausnahmen bekannt.[4]
Benzyl-Allylspaltung
Aromaten, die Doppelbindungen besitzen, führen ähnlich wie Heteroatome zu Alpha-Spaltungen. Benzylspaltungen sind hierbei ausgeprägter als Allylspaltungen, da der Energiegewinn bei ersteren größer ist.
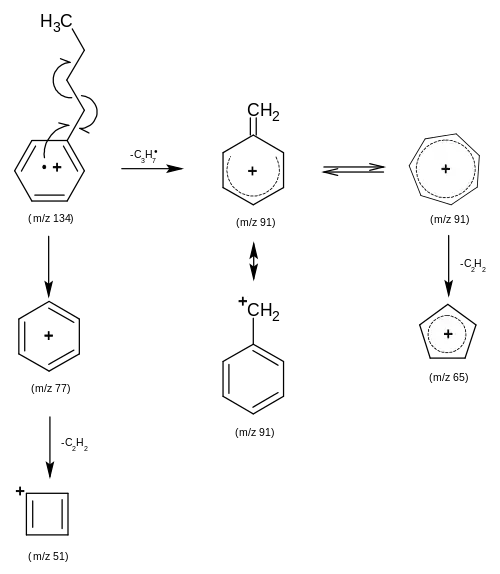
- Dargestellt ist der Verlauf der Benzylspaltung von Butylbenzol. Das ist Massenspektrum dominierende Hauption mit m/z 91 (Mitte) entsteht durch den Verlust eines Propyl-Radikals. Die hohe Intensität im Spektrum resultiert aus der großen Stabilität des Ions. Sowohl die Ladung wie auch das Radikal sind bei den Molekülen in der ersten Reihe und zweiten Reihe rechts durch Doppelbindungen über den Ring verteilt und so besser stabilisiert.
Wenn in einem Molekül eine Doppelbindung vorhanden ist, kann von einer Lokalisierung der Ladung an dieser ausgegangen werden. Am wahrscheinlichsten sind dann die Bildung eines Allylions durch Homolyse oder ein Allylradikal durch Heterolyse. Theoretisch könnte durch die resultierende Masse so bei offenkettigen Molekülen die Position der Doppelbindung herausgefunden werden. Praktisch ist dies leider nicht möglich, da der Fragmentierungsreaktion zahlreiche Isomerisierungsreaktionen vorausgehen. Diese Isomerisierungen können als Wasserstoffumlagerungen betrachtet werden. In alicyclische Verbindungen sind solche Isomerisierungen seltener. Eindeutige Ergebnisse liefert die Spaltung dagegen in Aromaten, da diese sehr stabil sind. Die Spaltung der Benzylbindung ist stark begünstigt, wodurch das Benzylion erzeugt wird. Dieses taucht bei fast allen Verbindungen, die Benzyl enthalten, als intensives Signal bei m/z 91 auf.[5]
Retro-Diels-Alder-Reaktion
Bei der Retro-Diels-Alder-Reaktion wird ein Sechsring mit einer Doppelbindung entzyklisiert (zweifach gespalten) und man erhält eine En- und eine Dienkomponente. Das Dien ist der bevorzugte Ladungsträger. Die Retro-Diels-Alder-Reaktion kann sowohl im Molekülion, als auch in einem Fragment stattfinden.[4] Die Reaktion liefert, sofern kein Stickstoff vorhanden ist, geradzahlige Fragmente aus geradzahligen Molekülionen, was unter den sonst meist ungeradzahligen Fragmenten auffällt.[6] Der entzyklisierte Ring kann, muss jedoch keine Heteroatome enthalten. Die Reaktion reagiert selbst auf geringfügige Strukturänderungen sehr sensibel; während eine bestimmte Verbindung einen starken Peak im Massenspektrum bildet, kann es sein, dass eine sehr ähnliche Verbindung fast nicht im Massenspektrum zu erkennen ist.
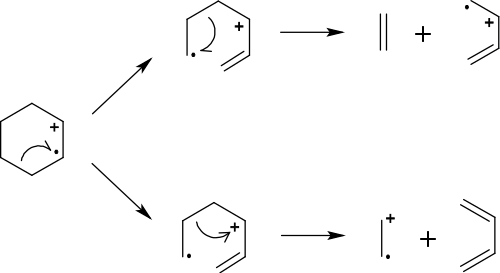
- Dargestellt ist die Retro-Diels-Alder-Reaktion. Oben und in der Mitte findet jeweils eine Homolyse statt, unten dagegen eine Heterolyse.
Bei der Diels-Alder-Reaktion findet die anfängliche Ionisierung in jedem Fall an der Doppelbindung statt. Im Folgenden sind zwei Reaktionsverläufe möglich, in welchen die Ladung entweder an der ursprünglichen Stelle verbleibt oder aber verschoben wird.[3]
Die Retro-Diels-Alder-Reaktion in der Massenspektrometrie sollte nicht mit der ebenfalls als Retro-Diels-Alder-Reaktion bezeichneten Cycloreversion verwechselt werden. Letztere ist eine konzertierte Reaktion von nicht-ionisierten Diels-Alder-Addukten.
McLafferty-Umlagerung
Bei der McLafferty-Umlagerung wird über einen sechsgliedrigen Übergangszustand ein gammaständiges H-Atom auf ein wenigstens doppelt gebundenes Atom übertragen. Dabei wird die alpha-Bindung gespalten, ein Neutralteilchen frei und die Doppelbindung verschoben. Die für die McLafferty-Umlagerung nötige Doppelbindung muss nicht bereits im Ursprungsmolekül vorhanden sein, sondern kann auch im Rahmen einer Fragmentierungsreaktion erst gebildet werden, z. B. durch eine Alpha-Spaltung. Das Akzeptormolekül für das Proton können unter anderem eine C=O, C=N oder eine C=C-Bindung sein. Sollte am gamma-C-Atom kein H-Atom vorhanden sein, findet die Reaktion auch nicht statt. Die McLafferty-Umlagerung ist eine analoge Reaktion zur Norrish-Typ-II-Reaktion.
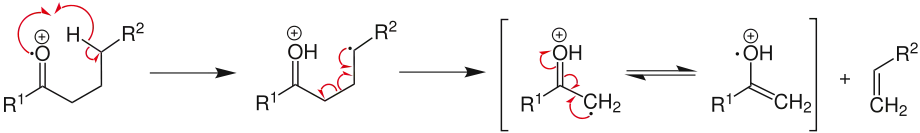
- Dargestellt ist die McLafferty-Umlagerung mit einem Sauerstoffatom als doppelt gebundenes Atom.
Neutralverlust
Um ein Massenspektrum zu identifizieren, ist es meist nötig, den M+.-Peak zu identifizieren. Die folgende Tabelle kann dabei helfen, sie enthält einige neutrale (ungeladene) Fragmente, die sich u. a. vom Molekülion abspalten können. Prinzipiell lässt sich die Tabelle auch auf Sekundärfragmentationen anwenden, am nützlichsten ist sie jedoch für Abspaltungen vom Molekülion, da sonst eine Massendifferenz, die auch in dieser Tabelle gefunden werden kann, nicht unbedingt durch einen Neutralverlust entstanden sein muss.
Auf diese Weise können außerdem Vermutungen über ursprünglich im Molekül vorhandene Strukturen aufgestellt werden. Des Weiteren ist zu beachten, dass auch mehrere Neutralverluste aufeinander folgen können.[3]
| Masse | Molekül |
|---|---|
| M-1 | H. |
| M-15 | CH3. |
| M-16 | NH2. |
| M-17 | OH., NH3 |
| M-18 | H2O |
| M-19 | F. |
| M-20 | HF |
| M-26 | HCCH, CN. |
| M-27 | HCN, H2C=C.H |
| M-28 | CO, H2C=CH2 |
| M-29 | CH3C.H2, HCO. |
| M-30 | H2CO |
| M-31 | CH3O. |
| M-32 | CH3OH, S |
| M-33 | HS. |
| M-35 | Cl. |
| M-36 | HCl |
| M-42 | H2C=C=O, H2C=CH-CH3 |
| M-43 | CH3C.O, C3H7. |
| M-44 | CO2 |
| M-45 | CH3CH2O., .CO2H |
| M-46 | NO2 |
| M-57 | CH3CH2C.O, .C4H9 |
| M-77 | C6H5. |
| M-79 | Br. |
| M-80 | HBr |
| M-91 | C6H5C.H2 |
| M-127 | I. |
Einzelnachweise
- Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie. 7. Auflage. Georg Thieme, Stuttgart 1995, ISBN 3-13-576105-3, S. 250.
- Josef Seibl, Walter Wolfgang: Massenspektrometrie Studienbuch für Studierende der Chemie nach dem Vordiplom. 2. Auflage. Akademische Verlagsgesellschaft, Frankfurt am Main 1970, ISBN 3-400-00000-0, S. 64–67.
- R. Martin Smith: Understanding mass spectra: a basic approach. 2. Auflage. John Wiley & Sons, New Jersey 2004, ISBN 0-471-42949-X, S. 164–166.
- Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie. 7. Auflage. Georg Thieme, Stuttgart 1995, ISBN 3-13-576105-3.
- Josef Seibl, Walter Wolfgang: Massenspektrometrie Studienbuch für Studierende der Chemie nach dem Vordiplom. 2. Auflage. Akademische Verlagsgesellschaft, Frankfurt am Main 1970, ISBN 3-400-00000-0, S. 56–59.
- Josef Seibl, Walter Wolfgang: Massenspektrometrie Studienbuch für Studierende der Chemie nach dem Vordiplom. 2. Auflage. Akademische Verlagsgesellschaft, Frankfurt am Main 1970, ISBN 3-400-00000-0.