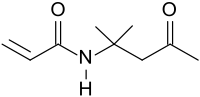
Diacetonacrylamid
Diacetonacrylamid ist ein funktionelles Monomer, das über seine Ketongruppe zu Vernetzungsreaktionen, z. B. mit Hydrazinen, befähigt ist und u. a. in Photopolymeren Verwendung findet. Wegen seines vergleichsweise positiven toxikologischen Profils wird Diacetonacrylamid statt der bisher gebräuchlichen Vinylmonomeren wie Styrol, Vinylpyrrolidon und Vinylcaprolactam oder Acrylate zunehmend als Comonomer u. a. für strahlenhärtende Druckfarben eingesetzt.[6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diacetonacrylamid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H15NO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis leicht blassgelbes Kristallpulver[1] bzw. hellgelbe Flocken[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser, Methanol und zahlreichen anderen organischen Lösungsmitteln[1], wie z. B. Ethanol, 1-Hexanol, Aceton, Ethylacetat und Benzol, wenig löslich in Heptan und Petrolether[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Bei der Ritter-Reaktion von Acrylnitril mit Aceton[4][3][7] entsteht Diacetonacrylamid in Ausbeuten bis 70 %.
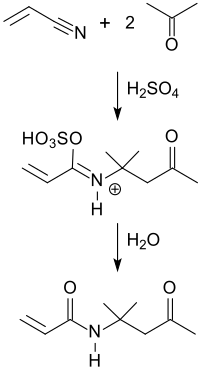
Das in stark exothermer Reaktion gebildete sulfonierte Zwischenprodukt[7] wird anschließend exotherm zu DAAM hydrolysiert.
Die Aceton-Kondensationsprodukte Diacetonalkohol[8] und Mesityloxid eignen sich ebenfalls als Ausgangsstoffe zur Herstellung von DAAM.
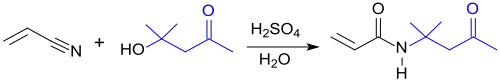
Die Ritter-Reaktion verläuft initial unter Bildung von Carbokationen durch Einwirkung starker Mineralsäuren auf den aus Aceton intermediär entstehenden Diacetonalkohol, wobei auch bei strikter Temperaturkontrolle eine Vielzahl von Nebenprodukten gebildet wird, darunter tert-Butanol, Mesityloxid, Diacetonalkohol, Mesitylen, Phoron, Isophoron und Acrylamid. Zur Optimierung von Zielproduktausbeute und Selektivität werden die Teilreaktionen zeitlich und räumlich getrennt, z. B. auch durch Einsatz von Mikroreaktionstechnik.[9] Dadurch können Reinausbeuten bis 78 % erhalten werden.
Die in der radikalischen Polymerisation für hohe Monomerumsätze und Molmassen erforderliche Reinheit (> 99 %) kann durch schonende Kurzwegdestillation und Umkristallisieren erreicht werden.
Eigenschaften
Diacetonacrylamid ist ein farbloser bis hellgelber kristalliner Feststoff, der durch Umkristallisation, z. B. aus Toluol/n-Hexan-Gemisch[8] gereinigt und zur Stabilisierung mit < 100 ppm MEHQ versetzt sein kann.[1] Die Substanz ist thermisch stabil und kann unter vermindertem Druck unzersetzt destilliert werden. Sie polymerisiert oberhalb ihres Schmelzpunktes und in Lösung bei Raumtemperatur.[4] Schwacher Geruch, hohe Hydrophilie und Löslichkeit in vielen organischen Lösungsmitteln, sowie vorteilhaftes toxikologisches Profil zeichnen Diacetonacrylamid gegenüber anderen reaktiven Monomeren aus.
Anwendungen
Diacetonacrylamid bildet als reaktives Monomer bei der radikalisch initiierten Polymerisation in Wasser wasserunlösliche, bei Polymerisation in Benzol wasserquellbare Homopolymere. Mit vielen anderen Monomeren, wie z. B. Acrylnitril, Acrylamid oder Vinylacetat, werden Copolymere erhalten, die sich u. a. in Cyclohexanon lösen.[4]
Der Einbau von Diacetonacrylamid-Einheiten in das Polymerrückgrat von Copolymeren verleiht diesen hydrophile Eigenschaften, wie erhöhte Wasserdampfpermeabilität von Polymerfilmen oder Kontaktlinsen, verbesserte Adhäsion von Klebstoffen und Dichtungsmassen, höhere Festigkeit und Filmbildungstendenz in Haarsprays, sowie Verstärkung von Papier- und Textilbeschichtungen.
Wichtigste Anwendungen für Diacetonacrylamid als funktionales Comonomer sind in wasserbasierten Beschichtungen und Lacken, die bei Raumtemperatur durch Reaktion mit Adipinsäuredihydrazid vernetzt werden können,[10][11]
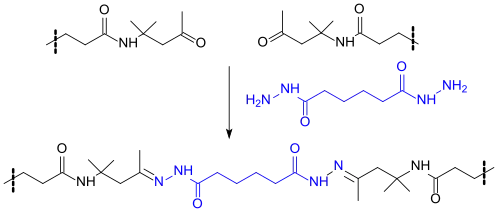
sowie in photovernetzbaren Druckfarben und Harzen.[12]
Einzelnachweise
- Eintrag zu Diacetone Acrylamide (stabilized with MEHQ) bei TCI Europe, abgerufen am 2. Januar 2019.
- Datenblatt Diacetone acrylamide bei Sigma-Aldrich, abgerufen am 2. Januar 2019 (PDF).
- Patent US3277056: N-3-Oxohydrocarbon-substituted acrylamides and polymers thereof. Angemeldet am 27. November 1963, veröffentlicht am 4. Oktober 1966, Anmelder: The Lubrizol Corp., Erfinder: L.E. Coleman.
- L.E. Coleman, J.F. Bork, D.P. Wyman, D.I. Hoke: Synthesis and polymerization of N-[2-(2-methyl-4-oxopentyl)]-acrylamide – A new reactive vinyl monomer. In: J. Polym. Sci. Part A: General. Band 3, Nr. 4, 1965, S. 1601–1608, doi:10.1002/pol.1965.100030427.
- Datenblatt Diacetone acrylamide bei AlfaAesar, abgerufen am 2. Januar 2019 (PDF) (JavaScript erforderlich).
- Patent US20170009091A1: Digital printing inks. Angemeldet am 17. August 2016, veröffentlicht am 12. Januar 2017, Anmelder: Sun Chemical Corp., Erfinder: S. Herlihy.
- N.V. Tale, R.N. Jagtap: Synthesis of diacetone acrylamide monomer and the film properties of its copolymers. In: Iranian Polym. J. Band 19, Nr. 10, 2010, S. 801–810 (sid.ir).
- Patent US3649688: Method for the preparation of N-3-oxohydrocarbon-substituted acrylamides. Angemeldet am 10. Juli 1969, veröffentlicht am 14. März 1972, Anmelder: The Lubrizol Corp., Erfinder: J. Gordon, P.R. Kaufman, D.I. Hoke.
- Patent EP1890801B1: Schrittweise Herstellung von Diacetonacrylamid. Angemeldet am 26. April 2006, veröffentlicht am 8. Juni 2011, Anmelder: DSM Fine Chemicals Austria NFG GmbH & Co KG, Erfinder: P. Pöchlauer, M. Kotthaus, M. Vorbach, M. Deak, T. Zich, R. Marr.
- N. Kessel, D.R. Illsley, J.L. Keddie: The diacetone acrylamide crosslinking reaction and its influence on the film formation of an acrylic latex. In: J. Coat. Technol. Res. Band 5, Nr. 3, 2008, S. 285–297, doi:10.10007/s11998-008-9096-6 (surrey.ac.uk [PDF]).
- X. Zhang, Y. Liu, H. Huang, Y. Li, H. Chen: The diacetone acrylamide crosslinking reaction and its control of core-shell polyacrylate latices at ambient temperature. In: J. Appl. Polym. Sci. Band 123, Nr. 3, 2012, S. 1822–1832, doi:10.1002/app.34660.
- Patent US3725231: Photosensitive diacetone acrylamide resins. Angemeldet am 20. August 1971, veröffentlicht am 3. April 1973, Anmelder: The Lubrizol Corp., Erfinder: R.W. Jahnke.
