Dextromethorphan
Dextromethorphan (abgek. oft: DXM) ist ein Arzneistoff, der auf das Nervensystem wirkt. Der Wirkstoff wurde als zentral (im Gehirn) wirksames Antitussivum (Hustenblocker) entwickelt. Heute weiß man, dass die Substanz ein potentes Psychotropikum ist, das auf zahlreiche Hirnfunktionen Einfluss nimmt.[9] Seit 2013 ist Dextromethorphan daher in den USA in fixer Kombination mit Chinidin zur Behandlung neurologischer Erkrankungen in Folge von Schädigungen des Gehirns zugelassen.[10]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
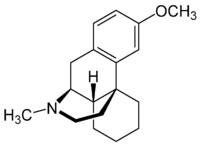 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dextromethorphan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 271,40 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,3[6] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser; leicht löslich in Chloroform[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Dextromethorphan war einer von drei Stoffen (neben Dextropropoxyphen und Diphenoxylat), die in von der CIA und US Navy finanzierten Forschung entdeckt wurde, der sich als nicht abhängigkeitserzeugendes Hustenmedikament zum Ersatz von Codein und Dihydrocodein eignete.[11] Das Patent für Dextromethorphan wurde 1954 angemeldet; im September desselben Jahres erkannte die FDA (Food and Drug Administration) es als Antitussivum an. Drei Jahre später wurde es auch ohne Rezept erhältlich. Eine Ausweitung der Zulassung zur Behandlung der pseudobulbären Affektstörung erfolgte erst 2011 (USA) und 2013 (Europäische Union). In den USA kam es seither zu einer Ausweitung der Indikationen, in der EU hat der Hersteller keine Verlängerung der Zulassung beantragt.
Anwendung als Arzneimittel
Anwendungsgebiete
Seit 1954 wird Dextromethorphan als zentral wirksames (auf das Nervensystem wirkendes) hustenstillendes Mittel gegen trockenen Husten und Reizhusten vermarktet. Darüber hinaus zeigt es Wirksamkeit bei der Behandlung neuropathischer Schmerzen und ist in den USA in fixer Verbindung mit Chinidin rezeptpflichtig zugelassen zur Behandlung von neurologischen Symptomen im Rahmen schwerer Hirnerkrankungen.[12]
Nebenwirkungen
Nebenwirkungen treten unter Dextromethorphan in geringer Dosierung relativ selten auf. Bei einem gewissen Prozentsatz der Bevölkerung (je nach Quelle 1–10 %) findet sich jedoch eine pharmakogenetische Schwäche des Cytochrom-P450-Enzyms CYP2D6, so dass bereits bei therapeutischer Dosierung Halluzinationen, Realitätsverlust und psychotische Episoden auftreten können. Gelegentlich sind Müdigkeit, Schwindel, Übelkeit und Erbrechen zu beobachten. Bei einer Überdosierung kann es zu Halluzinationen und psychotischen Episoden kommen.
Wechselwirkungen
Kontraindiziert ist die gleichzeitige Einnahme von bestimmten Antidepressiva (MAO-Hemmer,[13] Serotonin-wiederaufnahmehemmende Antidepressiva), da dies zum Serotoninsyndrom führen kann (Übelkeit, Bluthochdruck, Fieber, Tod).[14]
Dextromethorphan sollte nicht mit Alkohol kombiniert werden, da dies zu Wechselwirkungen wie Übelkeit führen kann.
Dextromethorphan sollte nicht mit dem Antihistaminikum Terfenadin kombiniert werden, da es zu lebensgefährlichen Wechselwirkungen kommen kann.[15] Des Weiteren wurden, insbesondere bei höheren Dosierungen, vereinzelt tödliche Wechselwirkungen auch mit Antihistaminika beobachtet.
Die Plasmahalbwertszeit liegt bei etwa 3,5 Stunden. Es gibt allerdings einen geringen Prozentsatz von Menschen, die den Wirkstoff Dextromethorphan sehr langsam abbauen (pharmakogenetische Schwäche des Cytochrom P450 Enzyms CYP2D6). Dadurch verlängert sich die Plasmahalbwertszeit von Dextromethorphan, so dass bereits bei therapeutischen Dosen ein starker Rauschzustand ausgelöst werden kann, der dem anderer Dissoziativa ähnelt. Der Mechanismus einer durch Chinidin verursachten Blockade der Verstoffwechslung mittels CYP2D6 wird bei der fixen Arzneimittelkombination Dextromethorphan/Chinidin (Markenname Nuedexta) therapeutisch genutzt. Chinidin soll durch CYP2D6-Blockade den Wirkstoffspiegel von Dextromethorphan im Blut länger aufrechterhalten.
Dextromethorphan sollte nicht in der Schwangerschaft genommen werden, da es in Verdacht steht, die fetale Hirnentwicklung negativ zu beeinflussen.
Pharmakologie
In seinem Wirkmechanismus unterscheidet sich Dextromethorphan deutlich von therapeutisch genutzten Opioiden und von seinem Enantiomer Levomethorphan. Pharmakologisch wird Dextromethorphan nicht mehr als Opioid klassifiziert, da es an keinem Opioidrezeptor gebunden wird. Die frühere Einstufung hängt damit zusammen, dass es als Agonist am Sigma-1-Rezeptor wirkt, welcher früher noch fälschlich zu den Opioidrezeptoren gezählt wurde. Zudem wirkt es als nichtkompetitiver Antagonist kanalblockierend an NMDA-Rezeptoren. Das erklärt die Wirksamkeit in der Schmerztherapie. Des Weiteren besitzt es u. a. eine Potenz als Dopamin-, Noradrenalin- und Serotoninwiederaufnahmehemmer.[16] Daher wird es zum Einsatz bei Depression, Zuständen nach Schlaganfall, Hirnverletzungen, Krampfanfallerkrankungen, Parkinson und Autismus erforscht bzw. bereits eingesetzt.[9] Bei therapeutischen Dosierungen ist nur selten mit einer psychischen oder körperlichen Abhängigkeit zu rechnen.[17]
Chemie
Stereochemie
Die Struktur des Dextromethorphan zeigt eine Verwandtschaft zu Opioiden, wie Codein und Morphin, unterscheidet sich aber grundlegend von ihnen in seiner Stereochemie. Seine Stereozentren in Position 9, 13 und 14 sind gegenüber denen der Opioide mit einem Morphin-Grundgerüst invertiert. Dextromethorphan ist das Enantiomer des Opioids Levomethorphan.
Chemische Eigenschaften
Das Dextromethorphan-Hydrobromid [(9S,13S,14S)-3-Methoxy-17-methylmorphinan·HBr] ist kaum löslich in Wasser. Es ist gut in Ethanol, Glycerol und Chloroform löslich.
Racematspaltung
Die Racematspaltung von (±)-3-Methoxy-N-methylmorphinan [(9S*,13S*,14S*)-3-Methoxy-17-methylmorphinan] erfolgt über die Bildung diastereomerer Salze mit D-Weinsäure.[18]
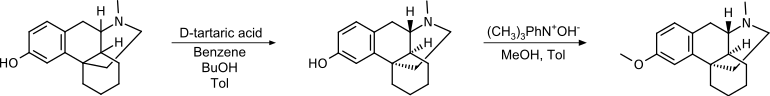
Dieser Syntheseweg wurde durch Roche im Jahr 1950 patentiert.
Traditioneller Syntheseweg
Der traditionelle Syntheseweg nutzt Raney-Nickel und wurde im Laufe der Zeit hinsichtlich Wirtschaftlichkeit, Ausbeute und Reinheit optimiert. Zu diesen Optimierungen zählt die Verwendung von Ibuprofen und ACl3.
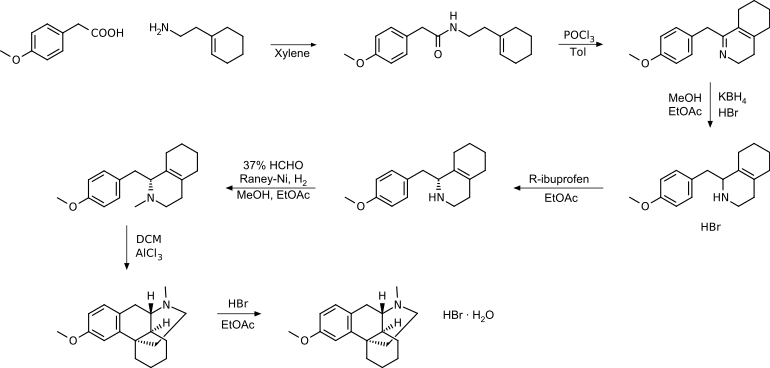
Insgesamt handelt es sich um eine kostengünstige Methode mit moderaten Reaktionsbedingungen, die einfach zu handhaben und für die industrielle Produktion geeignet ist.[19]
Grewe-Cyclisierung
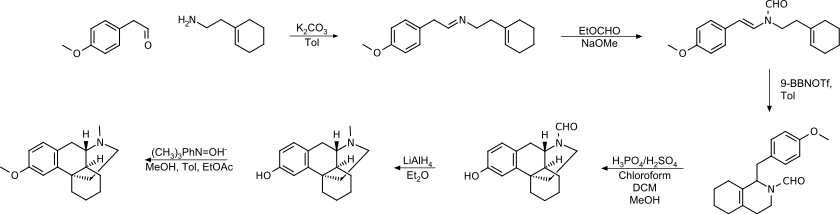
Die Grewe-Cyclisierung ist im Hinblick auf die verwendeten Chemikalien einfacher zu handhaben, liefert höhere Ausbeuten und eine höhere Reinheit des Produkts.[20]
Grewe-Cyclisierung mit Formylierung
Durch die Formylierung vor der Cyclisierung wird die Etherspaltung als Nebenreaktion vermieden und die Ausbeute ist höher als ohne N-Substitution oder N-Methylierung. In diesem Beispiel wurde die Reinigung durch Bildung eines Brucinsalzes durchgeführt.[19]
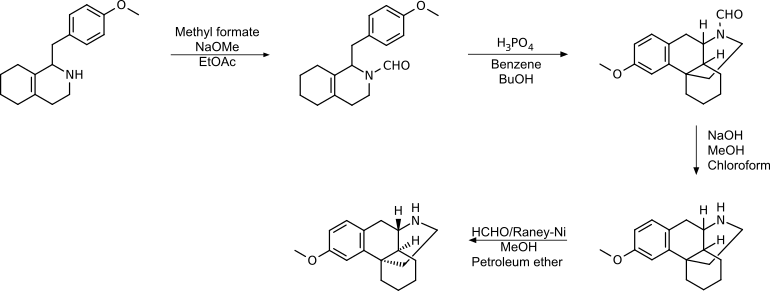
Diese Synthese wurde ebenfalls von Roche (1969) patentiert.
Gebrauch als Rauschmittel
Dextromethorphan wird bisweilen als Rauschmittel eingenommen, da es in höheren Dosen dissoziative Effekte hat, die denen von niedrig dosiertem Ketamin, oder LSD/Psilocybin ähneln können. Regelmäßige Einnahme kann zur Suchterkrankung führen.[21] Wie jede psychotrope Substanz kann auch Dextromethorphan zur substanzinduzierten Psychose führen. Obwohl Präparate mit Dextromethorphan in Deutschland nicht der Rezeptpflicht unterliegen, sollte der Wirkstoff trotzdem keinesfalls unterschätzt werden. Während direkt durch Dextromethorphan bedingte Todesfälle nicht bekannt sind, kam es jedoch zu Todesfällen durch andere in Kombinationspräparaten enthaltene Substanzen; insbesondere durch Paracetamol, weshalb speziell vor diesen Kombinationen besonders gewarnt wird.[22] Auch vor dem gleichzeitigen Gebrauch mit anderen psychoaktiven Substanzen, wie Benzodiazepinen, Amphetaminen (und deren Derivate), Opiaten und Opioiden, wird in Fachpublikationen gewarnt.
Handelsnamen
- als Antitussivum: Bexin (CH), Calmerphan (CH), Calmesin (CH), Dextro.Med (CH), Emedrin (CH), Hicoseen (CH), Hustenstiller-Ratiopharm (D), Irotussin (CH), NeoTussan (D), Pulmofor (CH), Silomat DMP (D), Tossa-X (CH), Tussastopp (A), Vicks Hustenpastillen/ Hustensirup (CH), Wick Formel 44 (A), Wick Hustenpastillen/ Hustensirup (D)
- als Antitussivum: Basoplex (D), Benical (CH), Contac Erkältungs-Trunk forte (D), Lindosan (A), Pretuval (CH), Vicks MediNait (CH), Wick DayMed Kapseln (D), Wick Erkältungssirup (A), Wick MediNait (D)
- als Psychotropikum: Nuedexta (EU)
Weblinks
Einzelnachweise
- Eintrag zu Dextromethorphan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2014.
- HCA Psychotropic Medication List (Memento vom 14. Juli 2014 im Internet Archive), abgerufen am 26. März 2014.
- L. A. Zawertailo, H. L. Kapla, U. E. Busto, R. F. Tyndale, E. M. Sellers: Psychotropic effects of dextromethorphan are altered by the CYP2D6 polymorphism: a pilot study. In: J Clin Psychopharmacol. 18(4), 1998, S. 332–337.
- J. Mutschler, A. Koopmann, M. Grosshans u. a.: Dextromethorphan Withdrawal and Dependence Syndrome. In: Dtsch Arztebl Int. 107(30), 2010, S. 537–540.
- Lawrence A. Labbate, Maurizio Fava, Jerrold F. Rosenbaum: Handbook of Psychiatric Drug Therapy. Philadelphia 2010.
- Sean Sweetman (Hrsg.): Martindale: The Complete Drug Reference. 35. Auflage. Buch und CD-ROM. Pharmaceutical Press, 2006, ISBN 0-85369-704-3.
- Datenblatt Dextromethorphan hydrobromide monohydrate bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- Eintrag zu Dextromethorphan in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Linda Nguyen, Kelan L. Thomas, Brandon P. Lucke-Wold, John Z. Cavendish, Molly S. Crowe, Rae R. Matsumoto: Dextromethorphan. An update on its utility for neurological and neuropsychiatric disorders. In: Pharmacology & Therapeutics. 159 (2016) 1–22. doi:10.1016/j.pharmthera.2016.01.016
- Information der Food and Drug Administration (FDA) der Vereinigten Staaten von Amerika. PDF
- Memorandum for the Secretary of Defense. (PDF) Abgerufen am 28. Juli 2013.
- Dextromethorphan gegen Gefühlsinkontinenz. (Memento vom 22. Februar 2014 im Internet Archive) In: Apotheke ad hoc. 1. Mai 2013. Abgerufen am 21. Januar 2014.
- M. Fink: Toxic serotonin syndrome or neuroleptic malignant syndrome? In: Pharmacopsychiatry. 29(4), 1996, S. 159–161. PMID 8858716.
- B. P. Skop u. a.: The serotonin syndrome associated with paroxetine, an over-the-counter cold remedy, and vascular disease. In: Am J Emerg Med. 12(6), 1994, S. 642–644. PMID 7945606.
- P. Kintz, P. Mangin: Toxicological findings in a death involving dextromethorphan and terfenadine. In: Am. J. Forensic Med. Pathol. 13(4), 1992, S. 351–352. PMID 1288270.
- Schweizer Compendium für medizinische Substanzen und ihre Indikationen: Dextromethorphan HBr. Stand Dez. 2019. Abgerufen am 15. Dezember 2019.
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie. Arzneimittelwirkungen verstehen - Medikamente gezielt einsetzen. Georg Thieme Verlag, 2010. Kapitel 13.2.1., Seite 188.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2, S. 615–616.
- Madhuresh Kumar Sethi: Preparation of Morphine Derivatives Using Ionic Liquids. In: Archives of Organic and Inorganic Chemical Sciences. 3, Nr. 2, 11. Juni 2018. doi:10.32474/AOICS.2018.03.000156.
- G. J. MEUZELAAR, E. NEELEMAN, L. MAAT, R. A. SHELDON: ChemInform Abstract: A Novel Synthesis of Substituted 1-Benzyloctahydroisoquinolines by Acid-Catalyzed Cyclization of N-[2-(Cyclohex-1-enyl)ethyl]-N-styrylformamides.. In: ChemInform. 30, Nr. 5, 17. Juni 2010. doi:10.1002/chin.199905129.
- Dextromethorphan: Entzugs- und Abhängigkeitssyndrom. In: Deutsches Ärzteblatt, Int. 107(30), 2010, S. 537–540.
- Abschnitt 4.11.4 der DXM-FAQ.