Cyclopentadienon
Cyclopentadienon ist eine chemische Verbindung aus der Gruppe der Ketone.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
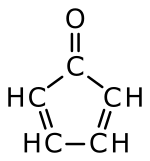 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cyclopentadienon | ||||||||||||
| Andere Namen |
Cyclopentadien-1-on | ||||||||||||
| Summenformel | C5H4O | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 80,09 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Cyclopentadienon kann bei tiefen Temperaturen aus mehreren Vorstufen (z. B. aus 1,2-Benzochinon[2]) photolytisch oder pyrolytisch erzeugt und in einer Argonmatrix bei 10 K isoliert werden. Es dimerisiert bereits beim Auftauen der Matrix (38 K).[3][4]
Eigenschaften
Substituierte Cyclopentadienone sind wichtige Synthesebausteine, die in der Naturstoffsynthese oder auch bei der Darstellung gespannter Verbindungen, wie z. B. Tetrahedranen, genutzt werden. Das erste und wohl auch am besten bekannte Beispiel eines monomeren Cyclopentadienons, das Tetraphenylcyclopentadienon, wurde 1925 von A. Löwenbein und G. Ulich veröffentlicht. In jüngerer Zeit hat die Metallorganische Chemie die Cyclopentadienone für sich entdeckt.
Deshalb begann schon frühzeitig die Suche nach deren Grundstruktur, wobei die ersten Arbeiten auf Klaus Hafner und Charles Herbert DePuy zurückgehen. Sie synthetisierten Cyclopentadienon durch Bromwasserstoff-Eliminierung aus dem entsprechenden Bromid oder Esterpyrolyse aus dem Acetat. Cyclopentadienon war dabei jedoch nicht direkt nachweisbar, da es sofort in einer Diels-Alder-Reaktion dimerisiert. Neben dem präparativen gab es auch ein theoretisches Interesse an der Verbindung aufgrund des ungewöhnlichen Reaktionsverhaltens der Substanzklasse. So lassen sich Cyclopentadienone in der Regel nicht zu Cyclopentadienen oder Hydroxycyclopentadienen durch Reduktion der Carbonylgruppe umsetzen, sondern liefern Cyclopentenone.
Für Cyclopentienon als Grundstruktur wurden zwei mesomeren Grenzstrukturen diskutiert, die eine Erklärung liefern sollten. Hierbei führt Grenzstruktur I zu einer antiaromatischen Destabilisierung des Ringes, da es sich um ein 4π-System handelt. Im Gegensatz dazu bildet sich in Grenzstruktur II unter Umpolung der Carbonylfunktion ein aromatisches 6π–System aus. Beide Grenzstrukturen sollten durch die Delokalisierung zu einer leichteren Reduzierbarkeit des Cyclopentadienons führen als bei einem System mit lokalisierten Bindungen. Zudem würde die Beteiligung von umgepolten Grenzstrukturen wie der II. auch die geringere Reaktivität der Carbonylfunktion erklären. Wie die Untersuchungen zeigten, spielen diese Grenzstrukturen in der Realität jedoch nur eine sehr untergeordnete Rolle.
Eine andere Erklärung lieferte die Molekülorbitaltheorie, die die Eigenschaften der Cyclopentadienone gut beschreibt, wobei diese vom geringen HOMO-LUMO-Abstand und dem energetisch sehr niedrig liegenden und stark delokalisierten LUMO bestimmt werden. So ist die schon angesprochene intensive Farbigkeit dieser Verbindungsklasse auf die π-π*-Übergänge zurückzuführen.[5][6]
Siehe auch
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Roger Brown: Pyrolytic Methods in Organic Chemistry Application of Flow and Flash Vacuum Pyrolytic Techniques. Elsevier, 2012, ISBN 978-0-323-15417-8, S. 173 (eingeschränkte Vorschau in der Google-Buchsuche).
- Günther Maier, Lothar Hermann Franz, Hans-Georg Hartan, Klaus Lanz, Hans Peter Reisenauer: Kleine Ringe, 54. Cyclopentadienon. In: Chemische Berichte. 118, 1985, S. 3196, doi:10.1002/cber.19851180819.
- William M. Horspool, Francesco Lenci: CRC Handbook of Organic Photochemistry and Photobiology, Volumes 1 & 2, Second Edition. CRC Press, 2003, ISBN 978-0-203-49590-2, S. 12-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael A. Ogliaruso, Michael G. Romanelli, Ernest I. Becker: Chemistry of Cyclopentadienones, Chem. Rev., 1965, Band 65, S. 261–367. doi:10.1021/cr60235a001.
- Dissertation: Scheppelmann, Imke. “Pyridylfunktionalisierte Cyclopentadienone : Synthese und Koordinationschemie.” Universität Bielefeld, 2002.