Antiaromatizität
Antiaromatizität[1][2] bezeichnet in der Chemie das Phänomen, dass cyclische Delokalisation von 4n Elektronen (n = 1, 2, 3 …) gegenüber einer linear konjugierten Referenz zu einer energetischen Destabilisierung und somit erhöhten Reaktivität führt. Sie ist somit das Gegenstück zum Phänomen der Aromatizität (Hauptartikel, vgl. dort für vertiefte Diskussionen), bei der cyclische Delokalisation von 4n + 2 Elektronen (n = 0, 1, 2 …) gegenüber einer linear konjugierten Referenz zu ernergetischer Stabilisierung und somit verringerter Reaktivität führt. Die Phänomene von Aromatizität und Antiaromatizität lassen sich in einfacher Form anhand der Hückel-Regel veranschaulichen. Verbindungen, welche das Phänomen der Antiaromatizität zeigen, werden als Antiaromaten, solche, die das Phänomen der Aromatizität zeigen, als Aromaten bezeichnet.
Während aromatische Systeme aufgrund ihrer hohen Stabilität in sehr großer Vielzahl anzutreffen sind, ist die Zahl der gut bekannten und untersuchten antiaromatischen Verbindungen aufgrund ihrer hohen Reaktivität vergleichsweise gering. Da antiaromatische Systeme zudem bestrebt sind, die ungünstige cyclische Delokalisation so weit wie möglich zu vermindern – z. B. durch Einnahme von Konformationen mit verringerter Konjugation – sind charakteristische physikalische Eigenschaften (Ringstöme, magnetische Eigenschaften) im Gegensatz zu den Aromaten meist nur schwach ausgeprägt (Diskussion der magnetischen Phänomene vgl. unter Aromatizität).
Obwohl Aromatizität und Antiaromatizität zu den fundamentalen Konzepten in der Chemie gehören, tut sich die Fachwelt schwer, eine kurze, umfassende und vollständige Definition der Begriffe zu finden. Die nachfolgende Tabelle fasst die üblichen Aspekte der beiden Phänomene nach dem gegenwärtigen Stand der Diskussion zusammen:[3]
| Eigenschaft | Aromat | Referenz (Olefin) | Antiaromat |
|---|---|---|---|
| Delokalisation / Konjugation | cyclisch | linear | cyclisch |
| Zahl der π-Elektronen | 4n + 2 | 2n | 4n |
| Energetischer Effekt der Konjugation | Stabilisierung | = Referenz | Destabilisierung |
| Ausmaß der Delokalisation | erhöht | = Referenz | erniedrigt |
| Bindungslängen | Tendenz zum Bindungslängenausgleich |
alternierend | alternierend |
| Diamagnetische Anisotropie | erhöht | – | klein |
| magnetic susceptibility exaltation[4] | hoch | – | niedrig |
| Ringstrom | diamagnetisch | – | paramagnetisch |
| NICS-Werte | deutlich negativ | – | deutlich positiv |
| Chemische Reaktivität | elektrophile Substitution | Addition | Addition |
| HOMO-LUMO-Differenz | erhöht | = Referenz | erniedrigt |
| Typische Vertreter | Benzol | Butadien | Cyclobutadien |
Historische Entwicklung
Während das Phänomen der Aromatizität bereits in der zweiten Hälfte des 19. Jahrhunderts bekannt war, wurde Antiaromatizität unter Chemikern erst gut 100 Jahre später durch Arbeiten von Breslow et al. intensiver diskutiert.[5][6]
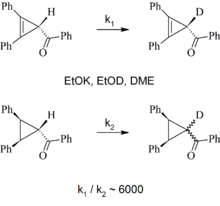
Die Diskussion beruhte auf der Beobachtung, dass die Acidität (bestimmt durch die Geschwindigkeit des H/D-Austausches) von Cyclopropenen gegenüber analogen Cyclopropanen herabgesetzt ist, obwohl das Anion des Cyclopropens nach einfacher Betrachtung durch die Konjugation mit der benachbarten Doppelbindung stabilisiert sein sollte. Da die verminderte Acidität Destabilisierung anzeigt, wurde das Cyclopropenyl-Anion als antiaromatisch klassifiziert. Dies ist in Einklang mit der Hückel-Regel (cyclische Delokalisation von 4n π-Elektronen). Eine wichtige Bestätigung finden diese Betrachtungen in der hohen Acidität von Cyclopentadien: das Cyclopentadienyl-Anion profitiert von aromatischer Stabilisierung (4n + 2 π-Elektronen), die Deprotonierung wird somit energetisch erleichtert.
Die Diskussion der Antiaromatizität bei Breslow et al. war stark auf den energetischen Aspekt der Antiaromatizität fokussiert. Arbeiten von Dauben et al., die im gleichen Zeitraum durchgeführt wurden und sich mit magnetischen Eigenschaften als Aromatizitätskriterium beschäftigten,[4] gruppierten Verbindungen wie [16]Annulen, Cyclooctatetraen und Heptalen noch unter dem Stichwort „pseudo-Aromaten“ ein. Obwohl von den Autoren bereits diskutiert wurde, dass in diesen Verbindungen schwache paramagnetische Ringstöme vorherrschen (Aromaten weisen diamagnetische Ringströme auf, vgl. unter Aromatizität) und diese bedingt durch Bindungslängenalternanz gegenüber den vollständig delokalisierten Modellsystemen in ihrem Ausmaß reduziert sind, hatte sich das Konzept „Antiaromatizität“ wie wir es heute verstehen noch nicht durchgesetzt.
Ähnlich wie bei den Aromaten hat sich seit diesen frühen Arbeiten ein deutlich breiteres Verständnis des Begriffes Antiaromatizität durchgesetzt, das neben energetischen Kriterien vor allem die magnetischen Eigenschaften – insbesondere in ihrer Auswirkung auf NMR-Phänomene (chemische Verschiebungen, NICS, vgl. Diskussion unter Aromatizität) – zur Diskussion heranzieht. Wie auch beim Studium der Aromaten haben leistungsfähige quantenchemische Methoden eine entscheidende Rolle bei der Entwicklung gespielt.
Energetische Aspekte

Delokalisation und Konjugation – zwei fundamentale Konzepte im Verständnis der chemischen Bindung – werden im Allgemeinen mit energetischer Stabilisierung verbunden. Im Sonderfall der Aromatizität mit ihrer cyclischen Konjugation/Delokalisation von 4n + 2 Elektronen erreicht die Stabilisierung dabei ein ungewöhnlich hohes Niveau. Dass die cyclische Konjugation von 4n Elektronen daher zu einer Destabilisierung führt, ist ein auf den ersten Blick überraschendes Phänomen – das jedoch zwanglos aus der quantenmechanischen Behandlung folgt (vgl. auch Quantenchemie). Die unterschiedliche Auswirkung der cyclischen Delokalisation lässt sich eindrücklich durch die Betrachtung einiger isodesmischer[7] Reaktionen von Cyclopropen und Cyclopentadien mit Cyclopropyl- bzw. Cyclopentyl-Kationen und -Anionen demonstrieren (vgl. nebenstehende Abbildung): Während die Bildung der aromatischen, cyclisch delokalisierten Systeme mit 2 bzw. 6 π-Elektronen (4n + 2, n = 0, 1, 2 … Hückel-Regel) deutlich exotherm verläuft, ist die Bildung der antiaromatischen Systeme mit 4 π-Elektronen (4n, n = 1, 2, 3 … Hückel-Regel) deutlich endotherm. Bei der Bewertung im Falle der antiaromatischen Systeme ist dabei zu beachten, dass in den entsprechenden Ionen bereits deutliche Bindungsalternanz vorherrscht, die zu einer Verminderung der Delokalisation führt. Reaktionsenthalpien für die Bildung der hypothetischen Systeme mit maximaler Delokalisation wären somit deutlich stärker endotherm.
Einzelnachweise
- Kenneth B. Wiberg: Antiaromaticity in Monocyclic Conjugated Carbon Rings. In: Chemical Reviews. 101, 2001, S. 1317, doi:10.1021/cr990367q.
- Annette D. Allen, Thomas T. Tidwell: Antiaromaticity in Open-Shell Cyclopropenyl to Cycloheptatrienyl Cations, Anions, Free Radicals, and Radical Ions. In: Chemical Reviews. 101, 2001, S. 1333, doi:10.1021/cr990316t.
- Eine Übersicht der aktuellen Diskussion zum Thema Aromatizität und Antiaromatizität findet sich in Chemical Reviews Vol. 101, Heft 5, 2001 sowie Vol. 105, Heft 10, 2005.
- Hyp J. Dauben, James Dennis. Wilson, John L. Laity: Diamagnetic susceptibility exaltation as a criterion of aromaticity. In: Journal of the American Chemical Society. 90, 1968, S. 811, doi:10.1021/ja01005a059.
- R. Breslow, J. Brown, J. J. Gajewski: Antiaromaticity of Cyclopropenyl Anions. In: Journal of the American Chemical Society. 89, 1967, S. 4383, doi:10.1021/ja00993a023.
- R. Breslow: Small Antiaromatic Rings. In: Angewandte Chemie International Edition in English. 7, 1968, S. 565, doi:10.1002/anie.196805651.
- Eintrag zu isodesmic reaction. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.I03272 – Version: 2.3.3.