London-Kraft
London-Kräfte (nach dem Physiker Fritz London;[1][2] in der Literatur auch London-Kraft, London-Dispersion oder anziehende Van-der-Waals-Bindung genannt) sind schwache Anziehungskräfte zwischen polaren oder unpolaren Molekülen[3] und Atomen, die durch spontane Polarisation eines Teilchens und dadurch induzierte Dipole in benachbarten Teilchen entstehen. In der Quantenmechanik können solche Wechselwirkungen als Kraftfeld modelliert werden, das mit der sechsten Potenz des Abstands abfällt:
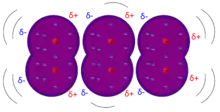
Die London-Kräfte erklären die Existenz von flüssigen und festen Aggregatzuständen unpolarer Verbindungen, die nicht existieren dürften, wenn man (in Abwesenheit anderer intermolekularer Wechselwirkungen wie Wasserstoffbrückenbindungen) nur die abstoßende Wechselwirkung ihrer Elektronenhüllen betrachtet. Die London-Kräfte zwischen unpolaren, ungeladenen Teilchen sind sehr viel schwächer als die anderen Bindungsarten. In der Computerchemie sind sie nur schwierig zu beschreiben und zu parametrisieren. Die Anteile der London'schen Dispersionskräfte an den Anziehungskräften zwischen polaren Molekülen sind meist stärker als die Beiträge der Dipol-Dipol-Wechselwirkung.[3] Zusammen mit den Debye'schen Kräften (Wechselwirkung zwischen permanenten Dipolmolekülen und unpolaren Teilchen) gehören diese zu den van-der Waalschen Wechselwirkungen.
Einzelnachweise
- R. Eisenschitz and F. London, Z. Physik 60, 491 (1930), DOI:10.1007/BF01341258.
- F. London, Z. Physik 63, 245 (1930), DOI:10.1007/bf01421741 and Z. Physik. Chemie, B11, 222 (1930)
- T.L. Brown, H.E. LeMay, B.E. Bursten, Chemie - Die zentrale Wissenschaft, 10. Aufl., Pearson Studium, München, Boston, 2007, S. 519.