Cobalt(II,III)-oxid
Cobalt(II,III)-oxid ist eine chemische Verbindung von Cobalt und Sauerstoff. Der schwarze Feststoff ist eines von mehreren Oxiden des Cobalts und zählt zur Gruppe der Spinelle.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
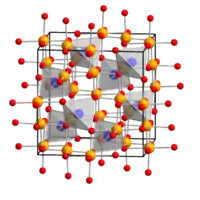 | |||||||||||||||||||
| _ Co3+ _ Co2+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cobalt(II,III)-oxid | ||||||||||||||||||
| Andere Namen |
Tricobalttetraoxid | ||||||||||||||||||
| Verhältnisformel | Co3O4 | ||||||||||||||||||
| Kurzbeschreibung |
schwarzer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 240,8 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
6,11 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
>900 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Cobalt(II,III)-oxid entsteht beim Erhitzen von Cobalt(II)-oxid an der Luft auf 400 bis 500 °C.[2]
Eigenschaften
Cobalt(II,III)-oxid ist eine gemischtvalente Verbindung mit zwei- und dreiwertigen Cobaltionen und der genaueren Formel Co2+Co3+2O4 (CoO·Co2O3). Die Verbindung besitzt eine Spinellstruktur, bei der in einer kubisch dichtesten Kugelpackung von O2−-Ionen ein Achtel aller Tetraederlücken und die Hälfte der Oktaederlücken von Cobaltionen besetzt sind. Die Co2+-Ionen besetzen dabei die Tetraederlücken, die Co3+-Ionen die Oktaederlücken.[2] Die Kristalle haben die Raumgruppe Fd3m (Raumgruppen-Nr. 227), der Gitterparameter a = 809 pm. In der Elementarzelle befinden sich acht Formeleinheiten.[3]
Ab etwa 900 °C zersetzt sich Cobalt(II,III)-oxid zu Cobalt(II)-oxid. Von Reduktionsmitteln wie Koks oder Aluminium wird die Verbindung zu elementarem Cobalt reduziert.[2]
Cobalt(II,III)-oxid ist in Salzsäure, Salpetersäure und Königswasser unlöslich, jedoch löslich in konzentrierter Schwefelsäure und in Kaliumhydrogensulfatschmelze.[3]
Verwendung
Cobalt(II,III)-oxid ist ein wichtiges Zwischenprodukt bei der Gewinnung von metallischem Cobalt. Durch Rösten und Auslaugen wird aus verschiedenen Cobalterzen (meist Sulfiden oder Arseniden) zunächst Cobalt(II,III)-oxid gewonnen. Dieses kann nun mit Kohlenstoff oder aluminothermisch zum Element reduziert werden.[2]
Cobalt(II,III)-oxid lässt sich als Katalysator zur Oxidation von Ammoniak zu Salpetersäure einsetzen. Dieses ist deutlich billiger als die sonst verwendeten Platin-Legierungen. Ein Nachteil ist allerdings die bisher geringere Selektivität von Cobalt(II,III)-oxid-Katalysatoren.[4]
Wie andere Cobaltverbindungen ist Cobalt(II,III)-oxid ein Blaupigment für das Färben von Keramiken.[5]
Sicherheitshinweise
Cobalt(II,III)-oxid wird als krebserregend und keimzellmutagen angesehen.[1]
Einzelnachweise
- Eintrag zu Cobalt(II,III)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1682–1687.
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 388 (eingeschränkte Vorschau in der Google-Buchsuche).
- Patentanmeldung EP0562567A1: Katalysator zur Oxidation von Ammoniak. Angemeldet am 23. März 1993, veröffentlicht am 29. September 1993, Anmelder: Topsoe Haldor AS, Erfinder: Poul Erik Hojlund Nielsen, Keld Johansen.
- Fa. Lehrer: Rohstoffübersicht Keramik (Memento vom 8. Januar 2004 im Internet Archive)
