Cellulasen
Cellulasen – auch selten Zellulasen geschrieben – sind Enzyme, die in der Lage sind, die β-1,4-glykosidische Bindung von Cellulose zu spalten, wodurch Glucose freigesetzt wird.
| Cellulasen | ||
|---|---|---|
| ||
| nach PDB 3L55 | ||
| Enzymklassifikationen | ||
| EC, Kategorie | 3.2.1.4, Hydrolase | |
| Reaktionsart | Endohydrolyse von 1,4-β-D-glukosidischen Bindungen | |
| Substrat | Cellulose, Lichenin, & β-D-Glucane | |
| EC, Kategorie | 3.2.1.91, Hydrolase | |
| Reaktionsart | Hydrolyse der 1,4-β-D-glucosidischen Bindungen der Cellulose ausgehend vom nicht reduzierenden Ende der Cellulosekette | |
| Substrat | Cellulose | |
| Produkte | Cellobiose | |
| EC, Kategorie | 3.2.1.21, Hydrolase | |
| Reaktionsart | Hydrolyse von 1,4-β-D-glukosidischen Bindungen | |
| Substrat | Cellobiose | |
| Produkte | beta-D-glucose | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien, Pilze | |
Natürliches Vorkommen
Pflanzen
Da Pflanzen selbst produzierte Cellulose in ihre Zellwände einbauen, benötigen sie endogene Cellulasen zum Umbau von Zellwänden, z. B. bei Wachstumsvorgängen. Bei dem pflanzlichen Cellulasegen handelt es sich um ein sehr altes Gen.[1]
Mikroorganismen
Viele Arten der Bakterien, Pilze (holzabbauende Organismen) und Flagellaten[2][3] besitzen Cellulasegene und sind daher direkt zum Cellulose-Abbau befähigt. Als Endosymbionten dienen sie vielen herbivoren Tieren, welche keine eigenen Cellulasegene besitzen.
Tiere ohne endogene Cellulase
Die meisten Tiere besitzen keine Cellulasegene und sind beim Celluloseabbau auf exogene Cellulasen ihrer Endosymbionten angewiesen. Sowohl die Wiederkäuer als auch die Nichtwiederkäuer nutzen stattdessen die Hilfe von endosymbiotischen Prokaryoten in speziellen Mägen oder Blinddärmen und können nur dadurch den Hauptanteil der Energie in pflanzlicher Nahrung nutzen.
Wiederkäuer verdauen einen großen Teil der Cellulose und anderer Polysaccharide im Pansen mithilfe anaerober Prokaryoten, die die Cellulose zu Fettsäuren umsetzen. Ähnliches gilt für Pferde und Wassergeflügel, bei denen die Verarbeitung jedoch im Dickdarm stattfindet.
Auch der Mensch besitzt keine Verdauungsenzyme für den Abbau von Cellulose. Mit Hilfe anaerober Bakterien im ersten Teil des Dickdarms, dem Blinddarm und dem aufsteigenden Colon wird ein Teil der Cellulose aus der Nahrung zu kurzkettigen Fettsäuren abgebaut. Über die Colonschleimhaut werden sie resorbiert und vom Stoffwechsel verwertet. Cellulose ist somit, neben Hemicellulosen, Pektin und Lignin, ein wichtiger pflanzlicher Ballaststoff in der menschlichen Nahrung.
Einige terrestrische Krebse wie die Isopoda können Cellulose mit der Unterstützung endosymbiotischer Bakterien abbauen.[4][5] Dasselbe gilt für Insekten wie fast alle Termiten[6][7] oder Schaben.[8] In 200 untersuchten Termitenspezies wurden mehr als 450 unterschiedliche Endosymbionten identifiziert.[9] Endosymbionten fossilierter Termiten wurden bereits aus der Kreidezeit direkt (in burmesischem Bernstein) nachgewiesen.[10] Die flügellosen Insekten der Insektenklasse Zygentoma (wie z. B. Silberfischchen) gehören dagegen zu den wenigen Tiergruppen, die körpereigene Cellulasen besitzen, also zum Verdauen von Cellulose nicht auf Endosymbionten angewiesen sind.
Bei den Pilzkulturen der Blattschneiderameisen handelt es sich um eine Exosymbiose mit Egerlingsschirmlingen (Leucoagaricus gongylophorus).
Tiere mit endogener Cellulase
Der Ansicht, dass Tieren grundsätzlich Cellulasen fehlen, widersprechen jedoch Berichte über Cellulase-Nachweise. Bei einigen Tieren konnte das Vorkommen endogener Cellulase oder von Cellulasegenen nachgewiesen werden. Dazu gehören wenige Vertreter der
- Manteltiere, zu den Chordatiere gehörend, haben einen Mantel aus Cellulose, was einzigartig im Tierreich ist.[11]
- Mollusken, wie
- einige Schnecken[11]: die Weinbergschnecke[12]
- Muscheln: Corbicula japonica und Lyrodus pedicellatus wurden Cellulase-Gene nachgewiesen[13]
- Krebse: Cherax destructor[14] und andere[15]
- Fadenwürmer: Bursaphelenchus xylophilus und der in Käfern lebende Pristionchus pacificus[16]
- Insekten:
- Termitenarten (Reticulitermes speratus und Coptotermes formosanus)[17][18][19][20][21]
- bei steril gehaltenen Silberfischchen wurde Celluloseabbau nachgewiesen,[22] dieser Nachweis einer endogenen Cellulaseaktivität ist jedoch nicht zweifelsfrei gelungen.
Herkunft und Evolution der tierischen Cellulasegene ist unheitlich: Für Nematoden wurde ein horizontaler Gentransfer, ausgehend von ihren Endosymbionten, verlautbart.[23][24] Ein Vorkommen eines Cellulasegens beim letzten gemeinsamen Vorfahren der Bilateria wird angenommen, woraus sich homologe Cellulasegene dieser Tiergruppe weiterentwickelten (vertikaler Gentransfer).[25]
Bestandteile
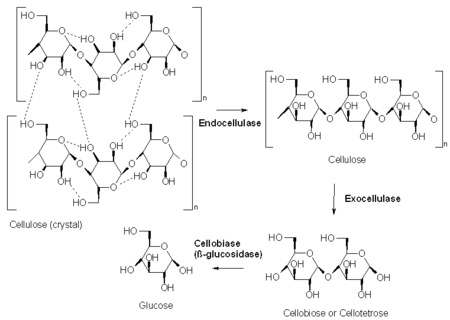
Die Gruppe der Cellulasen besteht aus drei verschiedenen Enzymtypen, deren Zusammenwirken eine rationelle Verdauung der riesigen Cellulosemoleküle (3- - 15-tausend verkettete Glucosemoleküle) ermöglicht:
1. Endoglucanasen (EC 3.2.1.4) spalten Cellulose in größere Abschnitte (sie können als einzige innerhalb der Celluloseketten arbeiten, aber nur innerhalb sogenannter amorpher Bereiche, wo die Cellulosemoleküle ungeordnet zueinander liegen und damit keine kristallinen Bereiche aufbauen). Dadurch erzeugen sie eine größere Anzahl von Kettenenden.
Viele Moleküle des 2. Enzyms, der Exoglucanasen (EC 3.2.1.91) können an diesen dann gleichzeitig – statt zeitraubend nur von einem Ende her – arbeiten und die Celluloseketten kontinuierlich verkürzen, indem sie immer zwei Zuckermoleküle als Doppelzucker (Disaccharid) Cellobiose abtrennen.
Die Moleküle des 3. Enzyms Cellobiase oder β-Glucosidase (EC 3.2.1.21) können dadurch wieder gleichzeitig arbeiten und als Abschluss des Zerlegungsprozesses schließlich die β-glycosidische Verbindung zwischen den beiden Glucose-Molekülen der Cellobiose hydrolysieren und damit die Glucose für weitere Stoffwechselprozesse (z. B. den Transport ins Blut bei der Verdauung) endgültig bereitstellen.
Verwendung und Gewinnung
Cellulasen haben mehrere kommerzielle Anwendungen in der Nahrungsmittel-, Waschmittel- und Textilindustrie. Zu diesem Zweck werden sie aus Kulturen (Submersfermentation) von Schimmelpilzen der Gattung Trichoderma, insbesondere T. reesei, isoliert. Diese kommen im Erdboden vor und gehören den Schlauchpilzen (Ascomycota) an.
In vielen Waschmitteln sind Cellulasen enthalten. In der Textilindustrie werden sie eingesetzt, um v. a. Jeansartikeln den beliebten „Used-Look“ zu geben. In der Verarbeitung von Kaffee werden sie zur Auflösung der Cellulose in den Bohnen während des Trocknungsvorganges verwendet. Des Weiteren werden Cellulasen für die Behandlung von Magen- oder Darmverschlüssen durch unverdautes Pflanzenmaterial (Phytobezoaren) und bei der Protoplastenisolierung aus Pflanzengeweben benutzt.
Einzelnachweise
- Angus Davison, Mark Blaxter: Ancient origin of glycosyl hydrolase family 9 cellulase genes. In: Molecular Biology and Evolution. Band 22, Nr. 5, 2005, S. 1273–1284.
- William Trager: The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. In: The Biological Bulletin. Band 66, Nr. 2, 1934, S. 182–190.
- Michael A. Yamin: Cellulose metabolism by the flagellate Trichonympha from a termite is independent of endosymbiotic bacteria. In: Science. Band 211, Nr. 4477, 1981, S. 58–59.
- M. Zimmer u. a.: Cellulose digestion and phenol oxidation in coastal isopods (Crustacea: Isopoda). In: Marine Biology. Band 140, Nr. 6, 2002, S. 1207–1213, doi:10.1007/s00227-002-0800-2.
- Martin Zimmer, Werner Topp: Microorganisms and cellulose digestion in the gut of the woodlouse Porcellio scaber. In: Journal of Chemical Ecology. Band 24, Nr. 8, 1998, S. 1397–1408, doi:10.1023/A:1021235001949.
- Moriya Ohkuma: Symbioses of flagellates and prokaryotes in the gut of lower termites. In: Trends in Microbiology. Band 16, Nr. 7 2008, S. 345–362. doi:10.1016/j.tim.2008.04.004
- Andreas Brune, Ulrich Stingl: Procaryotic symbionts of termite gut flagellates: Phylogenetic and metabolic implications of a tripartite symbiosis. In: Jörg Overmann (Hrsg.): Progress in Molecular and Subcellular Biology. Band 41, Springer Verlag, 2005, ISBN 3-540-28210-6.
- Michael Slaytor: Cellulose digestion in termites and cockroaches: what role do symbionts play?. In: Comparative Biochemistry and Physiology. Part B: Comparative Biochemistry. Band 103, Nr. 4, 1992, S. 775–784, doi:10.1016/0305-0491(92)90194-V.
- Michael A. Yamin: Flagellates of the orders Trichomonadida Kirby, Oxymonadida Grasse, and Hypermastigida Grassi & Foa reported from lower termites (Isoptera families Mastotermitidae, Kalotermitidae, Hodotermitidae, Termopsidae, Rhinotermitidae, and Serritermitidae) and from the wood-feeding roach Cryptocercus (Dictyoptera: Cryptocercidae). In: Sociobiology. Band 4, 1979, S. 113–117.
- George O Poinar Jr: Description of an early cretaceous termite (Isoptera: Kalotermitidae) and its associated intestinal protozoa, with comments on their co-evolution. In: Parasites & Vectors. Band 2, 2009, S. 12, doi:10.1186/1756-3305-2-12 open access
- Eintrag zu Cellulose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. August 2013.
- Fay L. Myers, D. H. Northcote: Partial Purification and some Properties of a Cellulase from Helix pomatia. (PDF; 1,3 MB). Department of Biochemistry, University of Cambridge, 23. Juli 1958.
- EC 3.2.1.4 - cellulase. bei: BRENDA. abgerufen am 9. August 2013.
- Benjamin J. Allardyce, Stuart M. Linton: and characterisation of endo-β-1, 4-glucanase and laminarinase enzymes from the gecarcinid land crab Gecarcoidea natalis and the aquatic crayfish Cherax destructor. In: Journal of Experimental Biology. Band 211, Nr. 14, 2008, S. 2275–2287.
- Allison C. Crawford, Neil R. Richardson, Peter B. Mather: A comparative study of cellulase and xylanase activity in freshwater crayfish and marine prawns. In: Aquaculture Research. Band 36, Nr. 6, 2005, S. 586–592.
- Käfer-Parasit mit ungewöhnlichen Genen: Genom des Fadenwurms Pristionchus pacificus entschlüsselt. g-o.de, 22. September 2008, abgerufen am 1. Juli 2012.
- H. Watanabe, Hiroaki Noda, G. Tokuda N. Lo: A cellulase gene of termite origin. In: Nature. 394, 1998, S. 330–331.
- Andreas Brune, Moriya Ohkuma: Role of the termite gut macrobiota in symbiotic digestion. In: David Edward Bignell (Hrsg.): Biology of Termites: A Modern Synthesis. 2010, Kapitel 16.
- K. Nakashima u. a.: Dual cellulose-digesting system of the wood-feeding termite, Coptotermes formosanus Shiraki. In: Insect Biochemistry and Molecular Biology. Band 32, Nr. 7, 2002, S. 777–784.
- Michael M. Martin, Joan S. Martin: Cellulose digestion in the midgut of the fungus-growing termite Macrotermes natalensis: The role of acquired digestive enzymes. In: Science. Band 199, Nr. 4336, 1978, S. 1453–1455.
- Hirofumi Watanabe u. a.: A cellulase gene of termite origin. In: Nature. Band 394, Nr. 6691, 1998, S. 330–331.
- Gerhard Heldmaier, Gerhard Neuweiler: Vegetative Physiologie. In: Vergleichende Tierphysiologie. Band 2. Springer, 2004, ISBN 3-540-00067-4, S. 327 (eingeschränkte Vorschau in der Google-Buchsuche).
- John T. Jones, Cleber Furlanetto, Taisei Kikuchi: Horizontal gene transfer from bacteria and fungi as a driving force in the evolution of plant parasitism in nematodes. (Memento des Originals vom 21. September 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Nematology. Band 7, Nr. 5, 2005, S. 641–646.
- Werner E. Mayer u. a.: Horizontal gene transfer of microbial cellulases into nematode genomes is associated with functional assimilation and gene turnover. In: BMC Evolutionary Biology. Band 11, Nr. 1, 2011, S. 13.
- Nathan Lo, Hirofumi Watanabe, Masahiro Sugimura: Evidence for the presence of a cellulase gene in the last common ancestor of bilaterian animals. In: Proceedings of the Royal Society of London. Series B: Biological Sciences. 270, Suppl 1 2003, s. S69–S72.
Literatur
- F. S. Chapin, P. A. Matson, H. A. Mooney: Principles of Terrestrial Ecosystem Ecology. Springer-Verlag, New York 2002, ISBN 0-387-95443-0.
- The Merck Manual of Diagnosis and Therapy. Chapter 24