Calciumthiosulfat
Calciumthiosulfat ist eine anorganische chemische Verbindung des Calciums aus der Gruppe der Thiosulfate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
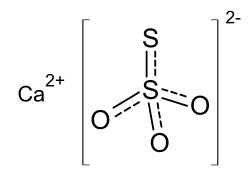 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumthiosulfat | ||||||||||||||||||
| Andere Namen |
Calciumthiosulphat | ||||||||||||||||||
| Summenformel | CaO3S2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
1,87 g·cm−3 (Hexahydrat)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Calciumthiosulfat kann durch Reaktion von Natriumthiosulfat mit Calciumchlorid gewonnen werden.[4]
Das Hexahydrat kann aus Thioschwefelsäure gewonnen werden.[4][5]
Die Verbindung kann auch durch Reaktion von Calciumsulfit und Schwefel bei 30–40 °C oder aus kochendem Kalk und Schwefel in Gegenwart von Schwefeldioxid hergestellt werden.[6]
Ebenfalls möglich ist die Darstellung durch Kochen von Calciumhydroxid mit Schwefel und Wasser, wobei zuerst Calciumpentasulfid und Calciumthiosulfat entsteht.
Eigenschaften
Calciumthiosulfat ist ein kristalliner Feststoff, der als Hexahydrat löslich in Wasser ist.[3] Er zersetzt sich bei Erhitzung über 45 °C.[2] Das Hexahydrat hat eine trikline Kristallstruktur mit der Raumgruppe P1 (Raumgruppen-Nr. 2) mit den Zelldimensionen a = 7,42±0,01, b = 9,48±0,01, c = 15.19±0,01 Å, α = 128,7±0,3, β = 100,1±0,3, γ = 143,1±3°.[7][8] Das Hexahydrat gibt bei 45 °C vier Teile Kristallwasser ab und die restlichen zwei bei 85 °C. Das Anhydrat zersetzt sich bei 112 °C zu Calciumsulfat, Schwefel und Schwefeldioxid.[4]
Verwendung
Calciumthiosulfat wird als Herbizid[9] verwendet. Es wird als Lösung kommerziell angeboten, wobei die klare Lösung wenig Geruch und einen pH-Wert im Bereich von 6,5–7,5 hat. Sie wird zur Dechlorierung, Ozon- und Wasserstoffperoxidabschreckung, in Beton- und Zementformulierungen, fotografischen Prozessen, Beschichtungen, Stabilisatoren und Reaktanden für Edel- und Nichtedelmetalle eingesetzt. Sie wird auch als "flüssiger Kalk" in der Landwirtschaft verwendet. Calciumthiosulfat ist ein Reduktionsmittel. Es wird routinemäßig als Titriermittel verwendet, um die Konzentration von Oxidantien wie Hypochlorit in der Bleiche und gelösten Sauerstoff in Wasser zu bestimmen. Es dechloriert sofort Wasser und wird verwendet, um eine Bleichreaktion in der Papierindustrie zu stoppen.[4] Es wird auch in der Gold- und Silbererzverarbeitung (Kiss-Prozess) eingesetzt.[10][11] Die Verbindung wird auch zur Behandlung von Dermatitis und Gelbsucht durch Arsphenamin eingesetzt.[12]
Einzelnachweise
- C. Arnold, G. Christ, K. Dietrich, Ed. Gildmeister, P. Janzen, C. Scriba, B. Fischer, C. Hartwich: Hagers Handbuch der Pharmaceutischen Praxis Für Apotheker, Ärzte, Drogisten und Medicinalbeamte. Erster Band. Springer-Verlag, 2013, ISBN 978-3-642-47350-0, S. 576 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Calciumthiosulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. April 2019. (JavaScript erforderlich)
- William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 159 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. Ballczo, O. Kaufmann: Calciumthiosulfat. In: Monatshefte für Chemie. 80, 1949, S. 220, doi:10.1007/BF00906465.
- Eintrag zu Calcium thiosulfate in der Hazardous Substances Data Bank, abgerufen am 5. April 2019 (online auf PubChem).
- Y. Elerman, A. Aydin Uraz u. a.: Crystal data for calcium and nickel thiosulphate hexahydrates: CaS2O3·6H2O and NiS2O3·6H2O. In: Journal of Applied Crystallography. 10, 1977, S. 362, doi:10.1107/S0021889877013673.
- Peter Held, Ladislav Bohatý: Calcium and strontium thiosulfate, CaS2O3·6H2O and SrS2O3·5H2O. In: Acta Crystallographica Section C Crystal Structure Communications. 60, 2004, S. i97, doi:10.1107/S0108270104017986.
- Nicholas P. Cheremisinoff, Paul Rosenfeld: Handbook of Pollution Prevention and Cleaner Production Vol. 3: Best Practices in the Agrochemical Industry. William Andrew, 2010, ISBN 978-1-4377-7825-0, S. 98 (eingeschränkte Vorschau in der Google-Buchsuche).
- Mike D. Adams: Gold Ore Processing Project Development and Operations. Elsevier, 2016, ISBN 978-0-444-63670-6, S. 498 (eingeschränkte Vorschau in der Google-Buchsuche).
- Carl Schnabel: Handbuch der Metallhüttenkunde Erster Band. Kupfer - Blei - Silber - Gold. Springer-Verlag, 2013, ISBN 978-3-642-50720-5, S. 947 (eingeschränkte Vorschau in der Google-Buchsuche).
- Robert Alan Lewis: Lewis' Dictionary of Toxicology. CRC Press, 1998, ISBN 978-1-56670-223-2, S. 217 (eingeschränkte Vorschau in der Google-Buchsuche).