Bis(2-ethylhexyl)peroxydicarbonat
Bis(2-ethylhexyl)peroxydicarbonat (auch Di-(2-ethylhexyl)-peroxydicarbonat, DEHPC) ist ein Diester der hypothetischen Peroxydikohlensäure. Die Verbindungen mit der allgemeinen Struktur R-OC(O)OO-(O)CO-R mit einer verzweigten 2-Ethyl-hexyl- (Isooctyl-) gruppe als R besitzen technische Bedeutung und liegen in der Regel als Stoffgemisch vor.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
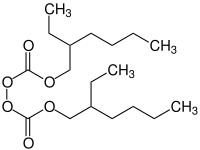 | ||||||||||||||||
| Vereinfachte Strukturformel – Gemisch von drei Stereoisomeren | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bis(2-ethylhexyl)peroxydicarbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C18H34O6 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 346,46 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck |
< 0,001 Pa (25 °C)[3] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, hydrolysiert zu 2-Ethylhexanol[3]
| |||||||||||||||
| Brechungsindex |
ca. 1,44 (15 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
DEHPC wird als Radikalstarter für die Polymerisation – z. B. von Vinylchlorid zu PVC – und für die Vernetzung von z. B. Polypropylen eingesetzt.
Isomerie

DEHPC besitzt je ein Stereozentrum an jeder Verzweigungsstelle der beiden 2-Ethylhexylreste, somit gibt es drei DEHPC-Stereoisomere:
- (R,R)-DEHPC,
- (S,S)-DEHPC und
- meso-DEHPC.
In der Technik wird DEHPC praktisch ausschließlich als Gemisch dieser drei Stereoisomeren eingesetzt. In der Regel haben derartige Stereoisomere unterschiedliche physiologische und somit auch toxikologische Eigenschaften.[6]
Vorkommen und Darstellung
Peroxydicarbonate sind thermisch instabile Perverbindungen und durch Acylierung von Wasserstoffperoxid mit Chlorameisensäureestern zugänglich. Bei der Reaktion eines Gemisches von 2-Ethylhexylchlorformiat (aus 2-Ethylhexanol und Phosgen einfach zugänglich) und verdünnter Wasserstoffperoxid-Lösung in Isopropanol mit verdünnter Natronlauge bei 15 °C wird Bis(2-ethylhexyl)peroxydicarbonat in 99,3%iger Ausbeute erhalten.[7]
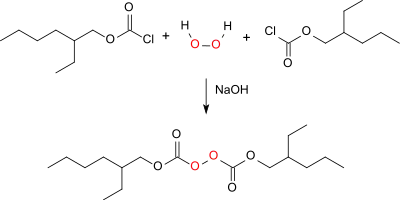
Die Reaktion wurde auch nach dem Verfahren der Mikroreaktionstechnik durchgeführt[8] und liefert ähnlich hohe Ausbeuten.
Eigenschaften
Bis(2-ethylhexyl)peroxydicarbonat ist eine klare farblose Flüssigkeit mit beißendem Geruch, die in Wasser unlöslich ist und schnell zu 2-Ethylhexanol hydrolysiert.
DEHPC ist in vielen organischen Lösungsmitteln, u. a. auch Mineralöl – in der technischen Literatur als OMS (engl. odourless mineral spirits) bezeichnet – oder Phthalsäureestern löslich.
Als Peroxoverbindung enthält DEHPC ca. 4,48 Gewichtsprozent Aktivsauerstoff und hat eine so genannte selbst beschleunigende Zersetzungstemperatur (SADT, self accelerating decomposition temperature) von ca. 0 °C[2] bzw. ca. 10 °C.[4] Die SADT ist die tiefste Temperatur, bei der innerhalb einer Woche selbst beschleunigende Zersetzung in der Transportverpackung auftreten kann und die bei Lagerung und Transport nicht überschritten werden darf.[9] DEHPC sollte daher unter −15 °C[4][3] bzw. −20 °C[10] gelagert werden. Verdünnung mit hochsiedenden Lösungsmitteln erhöht die SADT.
Die Halbwertszeit von DEHPC, bei der 50 % des Peroxydi-carbonats zersetzt sind, beträgt 10 Stunden bei 47 °C, eine Stunde bei 64 °C und 0,1 Stunden bei 83 °C und ist damit erheblich kürzer als bei dem Perester tert-Butylperoxybenzoat.[10]
Amine, Übergangsmetallionen, starke Säuren und Basen, starke Reduktions- und Oxidationsmittel, sowie Rost und Staub beschleunigen bereits in geringen Konzentrationen die Zersetzung von DEHPC.[3] Die Hauptzerfallsprodukte von DEHPC sind Kohlendioxid und 2-Ethylhexanol.[10]
Zugabe von ungesättigten Carbonylverbindungen, wie z. B. Ethylsorbat, Furan-2-carbonsäuremethylester oder Ethylcinnamat als Stabilisatoren erhöhen die SADT auf bis zu > 10 °C.[11]
Anwendungen
Bis(2-ethylhexyl)peroxydicarbonat findet Verwendung als Radikalstarter, der die Polymerisation von Monomeren zu Polymeren, wie z. B. von Ethylen zu LDPE, Vinylchlorid (VCM) zu Polyvinylchlorid (PVC), Vinylidenchlorid zu Polyvinylidenchlorid, Styrol zu Polystyrol oder Acrylsäureestern zu Polyacrylaten bzw. Methacrylsäureestern zu Polymethacrylaten und deren Copolymeren initiiert.[12]
Die Polymerisation von VCM zu PVC kann sowohl als Substanzpolymerisation als auch als Suspensionspolymerisation bei Temperaturen von 45–60 °C und Initiatordosen von 0,02–0,1 % ausgeführt werden.[4] Für eine gleichmäßigere Polymerisation und vollständigen Monomerumsatz werden Kombinationen von Bis(2-ethylhexyl)peroxydicarbonat mit thermisch stabileren Peroxiden, wie z. B. Dilauroylperoxid, eingesetzt.
Die Vernetzung von Polypropylen mit DEHPC zur Erzielung höherer Zugfestigkeiten und Schmelztemperaturen ist ebenfalls beschrieben.[13]
Bis(2-ethylhexyl)peroxydicarbonat wird als PEROXAN EPC S (PERGAN GmbH), Trigonox EHPS (AkzoNobel), Luperox 223S (Arkema) und EHPC-S (United Initiators) vermarktet.
Einzelnachweise
- Eintrag zu Bis(2-ethylhexyl)peroxydicarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Oktober 2021. (JavaScript erforderlich)
- akzonobel: Sicherheitsdatenblatt, Trigonox EHPS. AkzoNobel, abgerufen am 22. September 2018.
- Arkema: GPS Safety Summary, Substance Name: Di-2-ethylhexyl peroxydicarbonate, abgerufen am 27. Dezember 2019.
- United-initiators: EHPC-S, Technical Data Sheet – Polymerisation Peroxycarbonates, abgerufen am 27. Dezember 2019.
- O. Nuyken, J. Crivello: Poly(vinyl ether)s, Poly(vinyl ester)s, and Poly(vinyl halogenide)s in Handbook of Polymer Synthesis, Part A. Hrsg.: H.R. Kricheldorf. Marcel Dekker, Inc., New York 1992, ISBN 0-8247-8514-2, S. 176.
- E. J. Ariëns, Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology, European Journal of Clinical Pharmacology 26 (1984) 663–668, doi:10.1007/BF00541922.
- Patent US4394328: Production of peroxydicarbonates. Angemeldet am 27. März 1980, veröffentlicht am 19. Juli 1983, Anmelder: PPG Industries, Inc., Erfinder: J. A. Barter, D. E. Kellar.
- Patent EP1937630B1: Verfahren zur Herstellung organischer Peroxide mittels Mikroreaktionstechnik. Angemeldet am 13. Oktober 2006, veröffentlicht am 3. August 2011, Anmelder: Ehrfeld Mikrotechnik BTS GmbH und Pergan Hilfsstoffe für Industrielle Prozesse GmbH, Erfinder: A. Azzawi, H.-E. Mehesch, E. v. Zadow, S. Kirsch, M. Sondermann.
- The Society of the Plastics Industry, Organic Peroxide Producers Safety Division: SAFETY AND HANDLING OF ORGANIC PEROXIDES, 2012 edition (Memento vom 1. April 2016 im Internet Archive)
- Product Data Sheet, Trigonox EHPS. In: Produktdatenblatt. AkzoNobel, September 2015, abgerufen am 2. August 2016.
- Patent US7214812B2: Stabilized peroxydicarbonate preparation. Angemeldet am 26. Juni 2002, veröffentlicht am 8. Mai 2007, Anmelder: Peroxid-Chemie GmbH & Co. KG, Erfinder: E. Hägel, M. Kunz, W. Zeiss.
- Patent DE1927761: Verfahren zur Polymerisation olefinisch ungesättigter Verbindungen. Angemeldet am 30. Mai 1969, veröffentlicht am 10. Dezember 1970, Anmelder: Elektrochemische Werke München AG, Erfinder: H. Winter, H. Meyer, W. Edl, W. Meister, H. Schwarzer.
- Patent US5416169: Polypropylene having a high melt-tensile strength, a process for producing the same and a molded product from the same. Angemeldet am 5. November 1993, veröffentlicht am 16. Mai 1995, Anmelder: Chisso Corp., Erfinder: J. Saito, S. Kawazoe, S. Kikukawa.


