Biopterin
Biopterin ist eine heterocyclische Verbindung, die als Redox-Cofaktor im Stoffwechsel bedeutsam ist. Das wesentliche Strukturmerkmal ist ein heterocyclisches Pteridin-Ringsystem, damit ist es ein Derivat des Pterins.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
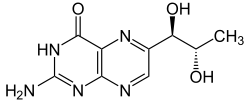 | ||||||||||||||||
| Strukturformel von L-erythro-Biopterin | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Biopterin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H11N5O3 | |||||||||||||||
| Kurzbeschreibung |
blassgelbe Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 237,22 g·mol−1 | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Biochemisch wird Biopterin durch Oxidation von Tetrahydrobiopterin mit GTP gebildet.[3]
Geschichte
Die Verbindung wurde in den 1950er Jahren von vier Forschergruppen in verschiedenen Quellen entdeckt. In den USA isolierte eine Arbeitsgruppe der Lederle Laboratories, einer Abteilung der American Cyanamid Company, aus 4000 Litern menschlichem Harn durch Adsorption an Aktivkohle, Gegenstromverteilung und Chromatographie ca. 20 Milligramm einer Substanz, welche in einem biologischen Test das Wachstum der Protozoe Crithidia fasciculata förderte. E. L. Patterson nannte sie Biopterin und leitete aus Abbauversuchen die Strukturformel ab.[4][5]
Unabhängig davon berichteten im selben Jahr H. S. Forrest und H. K. Mitchell vom California Institute of Technology (Pasadena), dass sie die Substanz neben anderen Pteridinen aus der Fruchtfliege Drosophila melanogaster (Wildtyp) isoliert hätten. Sie machten denselben Strukturvorschlag.[6]
Am Chemischen Institut der Universität Zürich hatten Max Viscontini und Mitarbeiter die Substanz (dort BH2 genannt) ebenfalls in Drosophila melanogaster entdeckt.[7][8]
Schließlich fanden am Max-Planck-Institut in München Adolf Butenandt und Heinz Rembold Biopterin im Weiselzellenfuttersaft (Gelée royale) der Honigbiene (Apis mellifica).[9]
In der Folgezeit wurde Biopterin noch in zahlreichen Organismen nachgewiesen; sein Vorkommen ist ubiquitär, was aus seiner biochemischen Funktion (siehe unten) verständlich ist.
Eigenschaften
Biopterin bildet kleine, gelbe Kristalle von sphärischem Habitus, die beim Erhitzen auf 250 bis 280 °C ohne zu schmelzen verkohlen. In Wasser sind sie mäßig löslich, besser jedoch sowohl in verdünnter Salzsäure als auch in verdünnter Natronlauge. Die Lösungen fluoreszieren im UV-Licht. Im Polarimeter bewirken sie eine Linksdrehung der Ebene des polarisierten Lichtes, zeigen also optische Aktivität.
Isomerie
Das Molekül ist chiral; die beiden Kohlenstoffatome der Seitenkette mit den HO-Resten sind Chiralitätszentren. In diesem Fall sind vier Stereoisomere möglich: RR, SS, RS, SR nach der Cahn-Ingold-Prelog-Konvention. Diese lassen sich auch als zwei Paare von Diastereomeren definieren, welche die erythro- bzw. threo-Konfiguration aufweisen, in Analogie zu den Kohlenhydraten Erythrose und Threose. Natürlich vorkommendes Biopterin (L-erythro-Biopterin) hat die (1R,2S)-Konfiguration. Weitere Isomere sind:
Synthesen
Die geringe Menge des Biopterins natürlichen Ursprungs erlaubte es den Entdeckern damals nicht, die Konfiguration der isolierten Verbindung zu bestimmen. Zur Aufklärung musste daher Biopterin aus einem Baustein im Chiral Pool synthetisiert werden, dessen Konfiguration feststand. Dieser wurde in der Klasse der Kohlenhydrate (Monosaccharide) gefunden. So synthetisierten Patterson et al. das Pterin aus L-Rhamnose oder dem chemisch modifizierten L-Arabinose-Derivat 5-Desoxy-L-arabinofuranosid und 2,4,5-Triamino-3,4-dihydropyrimidin-4-on (oft nach seinem Tautomeren 2,4,5-Triamino-4-hydroxypyrimidin oder besser 2,4,5-Triaminopyrimidin-4-ol genannt). L-Arabinose besitzt an den Kohlenstoffatomen C-3 und C-4 die erythro-Konfiguration, welche folglich auch in dem Derivat und schließlich der Seitenkette des Biopterins (C-1′, C-2′) vorliegen musste.[5] Die Konfiguration ist 1′S, 2′R (erythro).
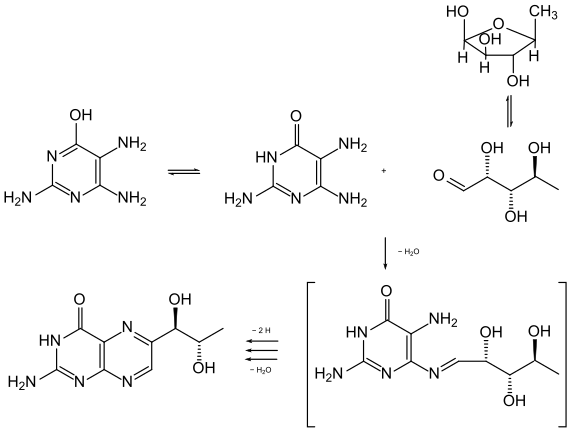
Reaktion von 2,4,5-Triamino-3,4-dihydropyrimidin-4-on mit 5-Desoxy-L-arabinofuranosid. Der erste Reaktionsschritt ist zweifellos die Bildung eines N-Glycosids und Azomethins (Schiffsche Base, Imin). Da diese sowohl mit der Aminogruppen an C-4 als auch an C-5 gebildet werden können, entstehen Stellungsisomere; im Bild ist nur eines gezeigt. Die weiteren Schritte, welche eine Dehydrierung beinhalten, sind unklar; eine Amadori-Umlagerung wurde diskutiert.
Da diese Kondensationsreaktion jedoch nicht selektiv war und eine schlechte Ausbeute ergab, wurden weitere Synthesen entwickelt. Aus D-Xylose wurde auch das D-threo-Diastereomer erhalten, welches keine wachstumsfördernde Wirkung auf Crithidia fasciculata zeigte.[13] Viscontini und Mitarbeiter optimierten die Synthese aus 5-Desoxy-L-arabinofuranosid in mehreren Arbeiten.[14][15] Für dieses Schlüssel-Intermediat wurde später ein neuer Weg aus L-Weinsäure gefunden.[16] Auch D-Ribose kann als Ausgangsmaterial verwendet werden.[17] Weitere Synthesen sind bei [16] zitiert.
Biologische Bedeutung
Biopterin – genauer das sich daraus ableitende Redoxpaar 7,8-Dihydrobiopterin/5,6,7,8-Tetrahydrobiopterin (letzteres auch BH4 abgekürzt) – spielt als Cofaktor eine wichtige Rolle im Stoffwechsel. Im Gegensatz zu den Pteridin-Abkömmlingen Folsäure und Riboflavin kann es jedoch vom menschlichen Körper selbst synthetisiert werden und ist somit nicht essentiell. Nur die Tetrahydroform des Biopterins ist biologisch aktiv.
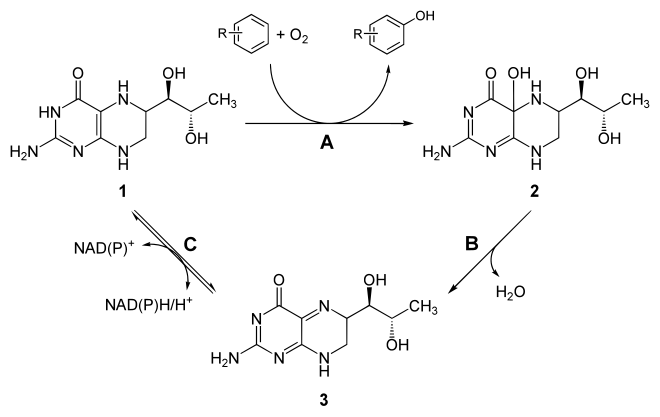
Besondere Bedeutung kommt dem Biopteridin-Redoxsystem bei der Oxidation aromatischer Ringe zu. Eine solche Oxidation findet z. B. bei der Biosynthese der Aminosäure Tyrosin aus Phenylalanin durch die Phenylalaninhydroxylase, bei der Synthese von Catecholaminen im Schritt der Oxidation des Tyrosins zur L-DOPA durch die Tyrosinhydroxylase oder bei der Serotonin-Biosynthese im Schritt der Oxidation des Tryptophans zum 5-Hydroxytryptophan durch die Tryptophanhydroxylase statt. Eine Besonderheit dieser Oxidationen ist, dass sie die Gegenwart molekularen Sauerstoffs erfordern (siehe auch Abbildung zuunterst).
Störungen im Biopterin-Stoffwechsel führen aufgrund der Bedeutung für den Metabolismus aromatischer Aminosäuren u. a. zu sogenannten „atypischen“ Phenylketonurien.
Die Stickstoffmonoxid-Synthase (NOS), die über mehrere Stufen Arginin zu Stickstoffmonoxid (NO) und Citrullin oxidiert, und die Alkylglycerol Monooxygenase (AGMO), die Etherlipide spaltet, sind ebenfalls tetrahydrobiopterinabhängig.[18]
Das Redoxsystem Dihydrobiopterin/Tetrahydrobiopterin ist vergleichsweise komplex – man betrachte dazu beispielsweise die Redoxsysteme der Cofaktoren NAD oder FAD. Für die Regeneration der oxidierten aus der reduzierten Form sorgt ein eigenes Enzymsystem: die Pterin-4a-carbinolamin-Dehydratase (EC 4.2.1.96) und die Dihydropteridin-Reduktase (EC 1.5.1.34). Die folgende Abbildung versinnbildlicht den zugehörigen Zyklus:
Weblinks
Einzelnachweise
- Eintrag zu Biopterin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Dezember 2011.
- Datenblatt 6-Biopterin bei Sigma-Aldrich, abgerufen am 8. November 2016 (PDF).
- Eintrag zu Pteridine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. Mai 2014.
- E. L. Patterson, H. P. Broquist, Alberta M. Albrecht, M. H. von Saltza, E. L. R. Stokstad: A new Pteridine in Urine required for the Growth of the Protozoon Crithidia fasciculata. In: J. Amer. Chem. Soc., 77, 1955, S. 3167–3168, doi:10.1021/ja01616a096.
- E. L. Patterson, M. H. von Saltza, E. L. R. Stokstad: The Isolation and Characterization of a Pteridine Required for the Growth of Crithidia fasciculata. In: J. Amer. Chem. Soc., 78, 1956, S. 5871–5873, doi:10.1021/ja01603a044.
- H. S. Forrest, H. K. Mitchell. In: J. Amer. Chem. Soc., 77, 1955, S. 4865.
- M. Viscontini, E. Loeser, P. Karrer, E. Hadorn: Fluoreszierende Stoffe aus Drosophila melanogaster. In: Helv. Chim. Acta, 38, 1955, S. 2034–2035, doi:10.1002/hlca.19550380744.
- M. Viscontini, E. Loeser, P. Karrer: Fluoreszierende Stoffe aus Drosophila melanogaster. Isolierung und Eigenschaften des Pteridins HB2. In: Helv. Chim. Acta, 41, 1958, S. 440–446, doi:10.1002/hlca.660410215.
- A. Butenandt, H. Rembold: [The royal jelly of the honey bee. II. Isolation of 2-amino-4-hydroxy-6-(1,2-dihydroxypropyl) pteridine]. In: Hoppe-Seyler’s Zeitschrift für physiologische Chemie. Band 311, Nummer 1–3, 1958, S. 79–83, ISSN 0018-4888. PMID 13548912, doi:10.1515/bchm2.1958.311.1.79.
- Externe Identifikatoren von bzw. Datenbank-Links zu L-threo-Biopterin: CAS-Nummer: 13039-82-2, PubChem: 135738580, ChemSpider: 13628150, Wikidata: Q27144825.
- Externe Identifikatoren von bzw. Datenbank-Links zu D-threo-Biopterin: CAS-Nummer: 13019-52-8, PubChem: 135909519, Wikidata: Q57742483.
- Externe Identifikatoren von bzw. Datenbank-Links zu D-erythro-Biopterin: CAS-Nummer: 13039-62-8, PubChem: 135449517, DrugBank: DB03886, Wikidata: Q41793745.
- M. Viscontini, H. Raschig. In: Helv. Chim. Acta, 41, 1958, S. 108.
- M. Viscontini, R. Provenzale. In: Helv. Chim. Acta, 52, 1969, S. 1225.
- B. Schircks, J. H. Bieri, M. Viscontini. In: Helv. Chim. Acta, 68, 1985, S. 1639. Dort sind weitere Synthesen der Zürcher Gruppe angegeben.
- Anne-Marie Fernandez, Lucette Duhamel: Total Synthesis of l-Biopterin from L-Tartaric Acid via 5-Deoxy-L-arabinose. In: J. Org. Chem., 61, 1996, S. 8698–8700, doi:10.1021/jo961426s.
- K. Mori, H. Kikuchi. In: Liebigs Ann. Chem., 1989, S. 1267.
- E. R. Werner, N. Blau, B. Thöny: Tetrahydrobiopterin: biochemistry and pathophysiology. In: The Biochemical journal. Band 438, Nummer 3, September 2011, S. 397–414, ISSN 1470-8728. doi:10.1042/BJ20110293. PMID 21867484. (Review).
