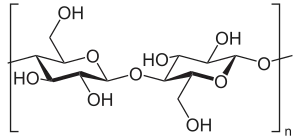
Beta-Glucane
Beta-Glucane (β-Glucane) bezeichnet eine Gruppe von verschiedenen hochmolekularen β-D-Glucose-Polysacchariden, welche in den Zellwänden von Getreide, Bakterien und Pilzen oder in freier Form als Paramylone in Algen vorkommen. Auch Cellulose und Chitin sind Glucane mit β-glycosidischer Bindung.
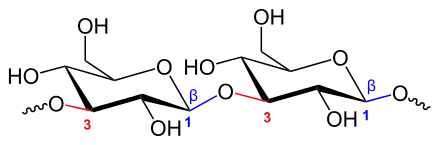
Im Wesentlichen treten β-1,3-, β-1,4- und β-1,6-Glucane auf. In Abhängigkeit von der Art der Bindung weisen Beta-Glucane signifikant unterschiedliche physikalisch-chemische Eigenschaften auf. Daher entfalten Beta-Glucane verschiedener Quellen im menschlichen Körper unterschiedliche Effekte. Die Nummerierung stammt von den an der Glucanbindung teilnehmenden C-Atomen der Glucose in seiner Sesselform.
Typen und Vorkommen
Beta-Glucane wurde erstmals in Flechten entdeckt und kurz darauf in Gerste.
β-Glucane sind ein natürlicher Bestandteil der Zellwände von Bakterien, Pilzen und Pflanzen. In Protisten können Beta-Glucane ungebunden in der Form von Paramylonen vorkommen.[1] Die verschiedenen Arten von Beta-Glucanen sind durch unterschiedliche Bindungen der Glucose-Moleküle charakterisiert, außerdem durch verschiedene Verzweigungsgrade und unterschiedliches Molekulargewicht, wodurch Löslichkeit und andere physiologische Eigenschaften wesentlich beeinflusst werden. Beta-glycosidische Bindungen können nicht unmittelbar von den meisten Tieren verstoffwechselt werden, da sie keine eigenen Verdauungsenzyme zur Spaltung der β-glycosidischen Bindung besitzen (allerdings besitzen sie dazu befähigte Enzyme außerhalb ihrer Verdauung, beispielsweise als Lysozym)[2]. Innerhalb ihrer Verdauung sind Mikroorganismen ihres Mikrobioms am Abbau von glyosidischen Bindungen engagiert. Wegen der trotzdem geringen Abbaurate zählen Beta-Glucane zu den Ballaststoffen.
Beta-Glucane aus Getreide bestehen aus β-1,3- und β-1,4-verknüpften D-Glucopyranose-Einheiten. Hefe-Beta-Glucane sind β-1,3- und β-1,6-glyosidisch verknüpft. Die Beta-Glucane in Gerste sind zu 27 % in den Wänden der Aleuronzellen und zu 73 % in den Zellwänden des Endosperms vorhanden,[3] während sich die Beta-Glucane des Hafers in der Subaleuronschicht konzentrieren.[4] Die Brotgetreide Weizen (0,8 %) und Roggen (2,3 %) enthalten nur geringe Mengen Beta-Glucan. Andere Quellen sind einige Algenarten[5], Protisten wie Euglena gracilis sowie verschiedene Arten von Pilzen wie Reishi (Glänzender Lackporling, Ganoderma lucidum), Ganoderma applanatum,[6] Shiitake, Chaga (Schiefer Schillerporling) und Maitake (Gemeiner Klapperschwamm).[7]
Für Nahrungsergänzungsmittel und Lebensmittel werden Beta-1,3-D-Glucane zum Beispiel aus der Zellwand der Backhefe Saccharomyces cerevisiae gewonnen oder sind natürlicher Bestandteil des Protisten Euglena gracilis.[1] Die so gewonnenen β(1,3)D-Glucane sind oft unlöslich. Beta-1,3- und Beta-1,4-Glucane werden auch aus Haferkleie sowie aus dem Korninneren von Gerste extrahiert. Von Beta-Glucan-Gersten dienen die Körner auch in Form von Gersten-Flocken und Gerstenmehl für Brote und Backwaren als Beta-Glucan-Lieferant.
Beim Brauen von Bier fallen Beta-Glucane als unerwünschte Nebenprodukte an, da sie ein Indikator für vermindertes Mälzen sind und die Viskosität der Bierwürze erhöhen.[8]
Eigenschaften
Je nach der Form des Beta-Glucan ergeben sich unterschiedliche Eigenschaften.
1,3-gebundene Beta-Glucane sind Ballaststoffe, welche nicht verdaut werden können, aber im Darm vom Körper als fremd erkannt werden. Beta-Glucane mit β-(1→3) und β-(1→6)-Verzweigung binden an die Rezeptoren Dectin-1, Komplementrezeptor 3 (CR3) und Toll-like Rezeptoren (TLR).[9] Einige Studien lassen darauf schließen, dass Beta-Glucane hierdurch immunmodulatorische Eigenschaften haben.
Eine tägliche Aufnahme von 3 g Beta-Glucan aus Gerste (1,3 u. 1,4) reduziert den LDL-Spiegel und kann das Risiko für Herz-Kreislauf-Erkrankungen senken.[10][11] Der genaue Stoffwechselprozess für diesen Effekt ist noch nicht geklärt.
Auch fördern Beta-Glucane das Wachstum gesunder Darmbakterien, wie dem Lactobazillus, in der Art eines Prebiotikums, also als "Futter" für die Bakterien.[12]
Lösliche Beta-Glucane finden als Ballaststoffe in verschiedenen medizinisch verwendeten Nahrungsergänzungsmitteln, in kosmetischen Produkten Anwendung und als Texturierungsmittel in Lebensmitteln Verwendung.
Wirkung
Durchblutung
Beta-Glucane aus Hafer und Gerste erzeugen eine Vielzahl von physiologischen Wirkungen, die sich teilweise positiv auf die Gesundheit auswirken. β-Glucane aus Gerste und Hafer wurden bei Probanden mit Hypercholesterinämie im Hinblick auf ihre Auswirkungen auf die Senkung des Herzinfarkt-Risikos untersucht.[13] Beta-1,3/1,4-Glucan senkt vermutlich einen erhöhten Cholesterinspiegel und vermindert damit einen wichtigen Risikofaktor für Gefäßerkrankungen, wie Arteriosklerose, Bluthochdruck, Herzinfarkt und Schlaganfall.[14]
Verdauung
Beta-Glucane aus Getreide erhöhen bei einer ausreichend hohen Konzentration in der Nahrung die Viskosität des Speisebreis im Magen-Darm-Trakt.[15] Sie verzögern so den Abbau der Nährstoffe, insbesondere den Aufschluss von Kohlenhydraten zu Zucker und die Resorption ins Blut. Der Verzehr von Hafer- und Gerstenprodukten mit einem hohen Beta-Glucan-Gehalt führt so zu einem geringeren Anstieg des Blutzuckerspiegels nach den Mahlzeiten und einer verringerten Insulinausschüttung.[16] Das Risiko von Übergewicht und anderen ernährungsbedingten Erkrankungen wie Typ-2-Diabetes, Herzinfarkt und Schlaganfall sinkt.[17]
Als lösliche Ballaststoffe werden die Beta-Glucane von der Darmflora zu Anionen kurzkettiger Fettsäuren wie Acetat, Butyrat und Propionat fermentiert. Die hierdurch bedingte Senkung des pH-Wertes verhindert insbesondere die Fehlbesiedlung des Dickdarms durch krankmachende Keime.[18] Kurzkettige Fettsäuren sind wichtige Regulatoren für einen gesunden Stoffwechsel. Butyrat ist der wichtigste Energielieferant für die Darmschleimhautzellen und wirkt entzündungshemmend.[19]
β-D-Glucan ist ein Teil der Zellwand von gewissen medizinisch relevanten Pilzen, insbesondere der Pilzarten Gießkannenschimmel (Aspergillus) und Champignons (auch Agaricus). Die Bestimmung der Anwesenheit von β-D-Glucan im Blut wird daher auch als Methode zur Diagnose invasiver Pilzinfektionen bei Patienten vermarktet.[20][21][22] Falsch positive Ergebnisse können aufgrund von Pilz-Kontaminationen in Antibiotika wie Clavulansäure-Amoxicillin,[23] und Piperacillin/Tazobactam auftreten. Falsch positive Ergebnisse können auch durch Kontamination klinischer Proben mit den Bakterien Streptococcus pneumoniae, Pseudomonas aeruginosa und Alcaligenes faecalis auftreten, welche auch (1→3)β-D-Glucan erzeugen.[24]
Immunsystem
Beta-Glucane aus Protisten und Pilz-Beta-Glucane wurden als "Modifikatoren der biologischen Immunantwort" erkannt.[25][26] Beta-1,3-1,6-Glucane als wesentliche Bestandteile der Zellwände von Pilzen, einigen Pflanzen und Bakterien sind Strukturen, die von unserem Immunsystem als Quasi-Erreger erkannt werden. Genauso wirken die Beta-1,3 aus dem Protisten Euglena Gracilis.[27]
In der Darmschleimhaut werden die Beta-Glucane von speziellen Rezeptoren (Dectin-1 u. a.), Fresszellen (Makrophagen) und Dendritischen Zellen erkannt und von diesen aufgenommen. Diese Immunzellen wandern danach über das Lymphsystem durch den Körper und sind auf weitere "pathogene (krankmachende)" Angriffe auf das Immunsystem, beispielsweise in den Atemwegen, bereits vorbereitet. Beta-Glucane führen somit indirekt zur Stärkung eines gesunden Immunsystems. Die Immunreaktion durch die Stimulierung der Fresszellen mit Beta-Glucanen ruft keine Krankheitssymptome hervor. Vielmehr sorgen die Fresszellen, die schon Beta-Glucane aufgenommen haben, für die Bildung von zusätzlichen Zellen für die Immunabwehr, wobei die in größere Anzahl dieser Abwehrzellen im Blut- und Lymphsystem dann den Körper leichter vor echten krankmachenden Erregern schützen können.[28][29]
Manche Beta-Glucane weisen antitumorale und antientzündliche Effekte auf.[30] Diese Eigenschaft entstammt der Regulation der Immunantwort durch Beta-Glucane.[31][32][33] Mehrere Studien stellten Auswirkungen auf die epitheliale Zell-Zytokin-Erzeugung fest.[34][35]
Einzelnachweise
- Dominique Turck, Jacqueline Castenmiller, Stefaan De Henauw, Karen Ildico Hirsch‐Ernst, John Kearney: Safety of dried whole cell Euglena gracilis as a novel food pursuant to Regulation. In: EFSA Panel on Nutrition, Novel Foods and Food Allergens (NDA). Band 18, Nr. 5, 14. Mai 2020, S. 1–14, doi:10.2903/j.efsa.2020.6100.
- Vivian Tullio, Roberta Spaccapelo, Manuela Polimeni: Lysozymes in the animal kingdom. In: Human and Mosquito Lysozymes: 2014, S. 45-57.
- Bhatty, R.S. (1986). Physiochemical and functional breadmaking properties of hull-les barley fractions. Cereal Chemistry. 63 (1): 31.
- Ternes, W. (1994). Naturwissenschaftliche Grundlagen der Lebensmittel-Zubereitung. Behrs Verlag. 2. Auflage.
- Teas, J (1983). The dietary intake of Laminarin, a brown seaweed, and breast cancer prevention. Nutrition and cancer. Lawrence Erlbaum Associates. 4 (3): 217–222. doi:10.1080/01635588209513760, PMID 6302638.
- Isolation and characterization of antitumor active β-d-glucans from the fruit bodies of Ganoderma applanatum. Carbohydrate Research. 115, 16 April 1983: 273–280. doi:10.1016/0008-6215(83)88159-2.
- Wasser, SP; Weis AL (1999). Therapeutic effects of substances occurring in higher Basidiomycetes mushrooms: a modern perspective. Critical reviews in immunology. United States: Begell House. 19 (1): 65–96. doi:10.1615/critrevimmunol.v19.i1.30, PMID 9987601.
- V. Sileoni, O. Marconi, G. Perretti: Near-infrared Spectroscopy in the Brewing Industry. In: Critical reviews in food science and nutrition. Band 55, Nummer 12, 2015, S. 1771–1791, doi:10.1080/10408398.2012.726659, PMID 24915307.
- N. Dalonso, G. H. Goldman, R. M. Gern: β-(1→3),(1→6)-Glucans: medicinal activities, characterization, biosynthesis and new horizons. In: Applied Microbiology and Biotechnology. Band 99, Nummer 19, Oktober 2015, S. 7893–7906, doi:10.1007/s00253-015-6849-x, PMID 26252967.
- Amtsblatt der Europäischen Union, Verordnung (EU) Nr. 1048/2012 Der Kommission vom 8. November 2012 zur Zulassung einer gesundheitsbezogenen Angabe über Lebensmittel betreffend die Verringerung eines Krankheitsrisikos, Artikel 14 Absatz 1 Buchstabe a: gesundheitsbezogene Angabe über die Verringerung eines Krankheitsrisikos.
- H. V. Ho, J. L. Sievenpiper, A. Zurbau, S. Blanco Mejia, E. Jovanovski, F. Au-Yeung, A. L. Jenkins, V. Vuksan: The effect of oat β-glucan on LDL-cholesterol, non-HDL-cholesterol and apoB for CVD risk reduction: a systematic review and meta-analysis of randomised-controlled trials. In: The British journal of nutrition. Band 116, Nummer 8, Oktober 2016, S. 1369–1382, doi:10.1017/S000711451600341X, PMID 27724985.
- Pasquale Russo, Paloma López, Vittorio Capozzi, Pilar Fernández de Palencia, María Teresa Dueñas: Beta-Glucans Improve Growth, Viability and Colonization of Probiotic Microorganisms. In: International Journal of Molecular Sciences. Band 13, Nr. 5, 18. Mai 2012, ISSN 1422-0067, S. 6026–6039, doi:10.3390/ijms13056026, PMID 22754347, PMC 3382753 (freier Volltext).
- Keogh, GF; Cooper GJ; Mulvey TB; McArdle BH; Coles GD; Monro JA; Poppitt SD (October 2003). Randomized controlled crossover study of the effect of a highly beta-glucan-enriched barley on cardiovascular disease risk factors in mildly hypercholesterolemic men. The American Journal of Clinical Nutrition. United States: American Society of Clinical Nutrition. 78 (4): 711–718. PMID 14522728.
- Braaten JT, Wood PJ, Scott FW, Wolynetz MS, Lowe MK, Bradley-White P, Collins MW: Oat (-glucan reduces blood cholesterol concentration in hypercholesterolemic subjects. Eur J Clin Nutrition 1994; 48:465-474.
- Anttila H., Sontag-Strohm T and Salovaara H. (2004). Viscosity of beta-glucan in oat products. Agricultural and Food Science. 13: 80-87.
- Amtsblatt der Europäischen Union, Verordnung (EU) Nr. 1048/2012 Der Kommission vom 8. November 2012 zur Zulassung einer gesundheitsbezogenen Angabe über Lebensmittel betreffend die Verringerung eines Krankheitsrisikos, Artikel 14 Absatz 1 Buchstabe a: gesundheitsbezogene Angabe über die Verringerung eines Krankheitsrisikos.
- EFSA Panel on Dietetic Products NaAN (2011). Scientific Opinion on the substantiation of health claims related to beta-glucans from oats and barley and maintenance of normal blood LDL-cholesterol concentrations (ID 1236, 1299), increase in satiety leading to a reduction in energy intake (ID 851, 852), reduction of post-prandial glycaemic responses (ID 821, 824), and “digestive function”' (ID 850) pursuant to Article 13(1) of Regulation (EC). No 1924/2006. EFSA Journal 9:2207 [21 pp.].
- Kasper, H. (2000). Ernährungsmedizin und Diätetik. Kapitel 1. 76-85 (2.1.). Urban & Fischer Verlag. München/Jena.
- Deutsche Gesellschaft für Ernährung (DGE) e.V. (2013). Ballaststoffe neu betrachtet. DGEinfo. 08: 114-118.
- Obayashi T, Yoshida M, Mori T, et al. (1995). Plasma (13)-beta-D-glucan measurement in diagnosis of invasive deep mycosis and fungal febrile episodes. Lancet. 345 (8941): 17–20. doi:10.1016/S0140-6736(95)91152-9.
- Ostrosky-Zeichner L, Alexander BD, Kett DH, et al. (2005). Multicenter clinical evaluation of the (1→3)β-D-glucan assay as an aid to diagnosis of fungal infections in humans. Clin Infect Dis. 41 (5): 654–659. doi:10.1086/432470, PMID 16080087.
- Odabasi Z, Mattiuzzi G, Estey E, et al. (2004). Beta-D-glucan as a diagnostic adjunct for invasive fungal infections: validation, cutoff development, and performance in patients with acute myelogenous leukemia and myelodysplastic syndrome. Clin Infect Dis. 39 (2): 199–205. doi:10.1086/421944, PMID 15307029.
- Mennink-Kersten MA, Warris A, Verweij PE (2006). 1,3-β-D-Glucan in patients receiving intravenous amoxicillin–clavulanic acid. NEJM. 354 (26): 2834–2835. doi:10.1056/NEJMc053340, PMID 16807428.
- Mennink-Kersten MA, Ruegebrink D, Verweij PE (2008). Pseudomonas aeruginosa as a cause of 1,3-β-D-glucan assay reactivity. Clin Infect Dis. 46 (12): 1930–1931. doi:10.1086/588563, PMID 18540808.
- Malkanthi Evans, Paul H. Falcone, David C. Crowley, Abdul M. Sulley, Marybelle Campbell: Effect of a Euglena gracilis Fermentate on Immune Function in Healthy, Active Adults: A Randomized, Double-Blind, Placebo-Controlled Trial. In: Nutrients. Band 11, Nr. 12, 3. Dezember 2019, ISSN 2072-6643, doi:10.3390/nu11122926, PMID 31816842, PMC 6950611 (freier Volltext) – (nih.gov [abgerufen am 10. Dezember 2020]).
- N. N. Miura, N. Ohno N, J. Aketagawa, H. Tamura, S. Tanaka, T. Yadomae: Blood clearance of (1→3)-beta-D-glucan in MRL lpr/lpr mice. In: FEMS Immunology and Medical Microbiology, Band 13, Nr. 1, Januar 1996, S. 51–57. doi:10.1016/0928-8244(95)00083-6.
- Malkanthi Evans, Paul H. Falcone, David C. Crowley, Abdul M. Sulley, Marybelle Campbell: Effect of a Euglena gracilis Fermentate on Immune Function in Healthy, Active Adults: A Randomized, Double-Blind, Placebo-Controlled Trial. In: Nutrients. Band 11, Nr. 12, 3. Dezember 2019, ISSN 2072-6643, doi:10.3390/nu11122926, PMID 31816842, PMC 6950611 (freier Volltext) – (nih.gov [abgerufen am 10. Dezember 2020]).
- G. D. Brown, S. Gordon: Immune recognition. A new receptor for beta-glucans. In: Nature, Band 413, Nr. 6851, September 2001, S. 36–37. bibcode:2001Natur.413...36B. doi:10.1038/35092620.
- V. Vetvicka, B. Dvorak, J. Vetvickova, J. Richter, J. Krizan, P. Sima, J. C. Yvin: Orally administered marine (1→3)-beta-D-glucan Phycarine stimulates both humoral and cellular immunity. In: International Journal of Biological Macromolecules, Band 40, Nr. 4, März 2007, S. 291–298. doi:10.1016/j.ijbiomac.2006.08.009.
- K. M. Bashir, J. S. Choi: Clinical and physiological perspectives of β-glucans: The past, present, and future. In: International Journal of Molecular Sciences, Band 18, Nummer 9, September 2017, doi:10.3390/ijms18091906.
- Elizabeth L. Adams: Differential high-affinity interaction of dectin-1 with natural or synthetic glucans is dependent upon primary structure and is influenced by polymer chain length and side-chain branching In: Journal of Pharmacology and Experimental Therapeutics, 2008.
- S. P. Wasser: Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides. In: Applied Microbiology and Biotechnology, November 2002.
- Barsanti, Laura (17 January 2011). Chemistry, physico-chemistry and applications linked to biological activities of β-glucans. Natural Product Reports.
- Hyung Sook Kim: Stimulatory effect of β-glucans on immune cells. In: Immune Network, August 2011.
- C. Tsukada, H. Yokoyama, C. Miyaji, Y. Ishimoto, H. Kawamura, T. Abo Immunopotentiation of intraepithelial lymphocytes in the intestine by oral administrations of beta-glucan. In: Cellular Immunology, Band 221, Nr. 1, Januar 2003, S. 1–5, doi:10.1016/S0008-8749(03)00061-3.