Dampf-Flüssigkeit-Gleichgewicht
Das Dampf-Flüssigkeit-Gleichgewicht (zumeist als VLE bezeichnet nach englisch Vapour-Liquid Equilibrium) ist ein Phasengleichgewicht, bei dem sich eine Flüssigkeit und ein Dampf bzw. Gas im thermodynamischen Gleichgewicht befinden. Das Dampf-Flüssigkeit-Gleichgewicht zeichnet sich auch dadurch aus, dass die Stoffmenge, die verdampft, der Stoffmenge entspricht, die kondensiert. Zudem ist das chemische Potential in beiden Phasen gleich.
Grundlagen
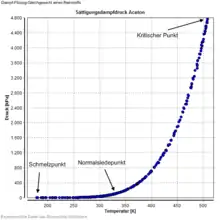
Ein Dampf-Flüssigkeit-Gleichgewicht wird bei Reinstoffen durch die Größen Druck und Temperatur eindeutig bestimmt, bei Gemischen müssen noch die Zusammensetzungen der flüssigen und dampfförmigen Phase angegeben werden. Zusammensetzungen werden zumeist als Stoffmengenanteil (Molenbruch) angegeben, x für die flüssige Phase und y für die Dampfphase. Ein Dampf-Flüssigkeit-Gleichgewicht existiert im Bereich zwischen dem Tripel- und dem kritischen Punkt. Der Druck, der sich im Dampf-Flüssigkeit-Gleichgewicht einstellt oder eingestellt wird, heißt Sättigungsdampfdruck.
Gemische
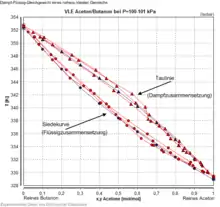
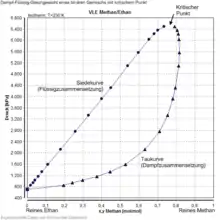
Gemisch-Dampf-Flüssigkeit-Gleichgewichte zeichnen sich dadurch aus, dass die Zusammensetzung der flüssigen und der dampfförmigen Phase sich zumeist unterscheiden. Dieser Effekt entsteht durch die unterschiedliche Flüchtigkeit und somit den unterschiedlichen Partialdruck der beteiligten Stoffe und wird in Trennverfahren, insbesondere der Rektifikation genutzt, um Gemische zu trennen. Der Leichtsieder reichert sich in der Dampfphase an, der Schwersieder hingegen in der flüssigen Phase. Die Rektifikation ist gegenwärtig das am häufigsten eingesetzte Verfahren zur Stofftrennung etwa in Erdölraffinerien. Systeme, in denen sich die Zusammensetzung nicht unterscheidet, heißen azeotrop und können durch Verdampfen nicht aufgetrennt werden.
Kenngrößen
Zur Beschreibung des Dampf-Flüssigkeit-Gleichgewichts eines Gemisches sind eine Reihe von Kenngrößen definiert worden:
- Trennfaktor, der das Verhältnis der Sättigungsdampfdrücke der beteiligten Komponenten beschreibt
- K-Faktor, der das Verhältnis der Stoffanteile einer Komponente in Dampf und Flüssigkeit beschreibt
- Relative Flüchtigkeit, die das Verhältnis zweier K-Faktoren beschreibt
Diese Kennzahlen dienen alle dazu, auf eine einfache Weise erkennen zu können, ob eine Rektifikation in sinnvoller Weise durchzuführen ist.
Typische Darstellungen
Reinstoff-Gleichgewichte werden zumeist einfach als Temperatur-Druck-Diagramme dargestellt, häufig jedoch werden der Logarithmus des Drucks gegen den Kehrwert der Temperatur aufgetragen, da diese Darstellung annähernd eine Gerade ergibt.
Gemisch-Dampf-Flüssigkeit-Gleichgewichte werden zumeist bei konstanter Temperatur oder konstantem Druck experimentell bestimmt. Daher werden VLE binärer Gemische üblicherweise bei konstantem Druck als Temperatur gegen Zusammensetzung und bei konstanter Temperatur als Druck gegen Zusammensetzung in der flüssigen und der Dampfphase dargestellt. Die Konzentrationsangaben im Dampf werden dabei als Taulinie bezeichnet, während die Abfolge der Flüssigzusammensetzungen als Siedelinie bekannt ist. Eine alternativ gebräuchliche Darstellung ist die Auftragung der beiden Zusammensetzungen in Flüssigkeit und Dampf x gegen y.
Modellierung
Ein Reinstoff-Dampf-Flüssigkeit-Gleichgewicht lässt sich durch einfache, häufig aus der Clausius-Clapeyron-Gleichung abgeleitete Gleichungen wie etwa der Antoine-Gleichung beschreiben. Diese Gleichungen benutzen stoffspezifische Parameter, die an experimentelle Dampfdruckdaten angepasst wurden.
Ein Gemisch-Dampf-Flüssigkeit-Gleichgewicht kann in erster Näherung durch das Raoultsche Gesetz beschrieben werden. Dies setzt jedoch ideales Verhalten der beteiligten Stoffe voraus. Zur Berücksichtigung der realen Verhaltens wird zumeist auf Aktivitätskoeffizienten-Modelle wie Non-Random-Two-Liquid-Modell (NRTL) oder UNIQUAC (Universal Quasichemical) zurückgegriffen, die die Gibbsche Exzessenergie beschreiben. Zur Abschätzung der Aktivitätskoeffizienten ist die Unifac Methode geeignet.
Literatur
- DECHEMA Chemistry Data Series, Band 1, Vapor-Liquid Equilibrium Data Collection, Diverse Autoren.
- „The Properties of Gases & Liquids“, Bruce E. Poling, John M. Prausnitz, John P. O'Connell, McGraw-Hill Professional, 2000, ISBN 0-07-011682-2
- Perry, R.H. and Green, D.W. „Perry's Chemical Engineers' Handbook“, 7. Auflage, McGraw-Hill, 1997, ISBN 0-07-049841-5
Siehe auch
- Henry-Gesetz
- Dortmunder Datenbank (Sammlung von Dampf-Flüssigkeit-Gleichgewichtsdaten von Gemischen und Sättigungsdampfdrücken reiner Stoffe, Basis der DECHEMA Chemistry Data Series)