Phasengrenzlinie
Unter einer Phasengrenzlinie oder Koexistenzkurve versteht man eine Linie im Zustandsraum eines thermodynamischen Systems, die Gleichgewichts-Zustände voneinander trennt, in denen das betrachtete thermodynamische System in Form verschiedenartiger Phasen vorliegt und/oder sich in der Zahl der gleichzeitig vorliegenden Phasen unterscheidet. Überschreitet ein thermodynamisches System eine Phasengrenzlinie, durchläuft es einen Phasenübergang. Phasendiagramme dienen zur graphischen Darstellung der Lage von Phasengrenzlinien in Projektionen des Zustandsraumes in zweidimensionale kartesische Koordinatensysteme[1] oder in Dreiecksdiagramme.[2]
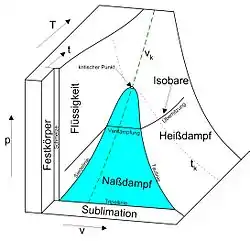
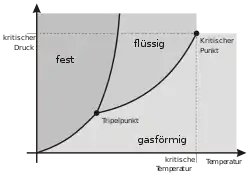

An bestimmten herausgehobenen Punkten innerhalb des Zustandsraums, wie etwa an Tripelpunkten und eutektischen Punkten, treffen mehrere Phasengrenzlinien aufeinander. Phasengrenzlinien, die in der Zustandsfläche des betrachteten thermodynamischen Systems Koexistenzgebiete mehrerer im Gleichgewicht koexistierender Phasen umschließen und die einen kritischen Punkt aufweisen, werden als Binodalen bezeichnet.[3][4] Phasengrenzlinien, die in Zustandsflächen thermodynamischer Systeme zwei Koexistenzgebiete voneinander abgrenzen, wobei eine der koexistierenden Phasen in beiden Koexistenzgebieten auftritt, heißen Tripellinien. Ein Beispiel hierfür ist die Tripellinie zwischen den Koexistenzbereichen flüssig-gasförmig und fest-gasförmig in Zustandsflächen von Reinstoffen, die in die Druck-Temperatur-Ebene projiziert als Tripelpunkt erscheint.
Beispiele für Phasengrenzlinien und die zugehörigen Phasenübergänge sind unter anderem:
Flüssigkeit → Gas:
- Siedekurve; Synonyme: Siedelinie, Siedepunktskurve, Siededruckkurve und Siedepunktkurve
- Bezeichnung des Phasenübergangs: Verdampfen (auch Sieden)
- Bezeichnung der Zustände während des Phasenübergangs: Siedepunkte/Siedebereich
- Der Verlauf der Siedepunktskurve lässt sich durch die Clausius-Clapeyron-Gleichung errechnen.
Gas → Flüssigkeit:
- Kondensationskurve; Synonyme: Kondensationslinie, (für Wasser auch Taulinie, Taukurve, Taupunktkurve, Taupunktlinie)
- Bezeichnung des Phasenübergangs: Kondensation
- Bezeichnung der Zustände während des Phasenübergangs: Kondensationspunkt/Kondensationsbereich
Übergänge Flüssigkeit → Gas und Gas → Flüssigkeit bei Reinstoffen:
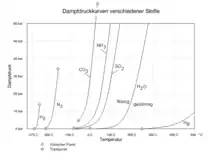
- Dampfdruckkurve[5]
- Bezeichnung der Phasenübergänge: Verdampfen/Sieden und Kondensation
- Eine Dampfdruckkurve ist eine Projektion der Siedekurve und der Kondensationskurve, die in der Druck-Volumen-Temperatur-Zustandsfläche zusammen den Koexistenzbereich von flüssiger Phase und Gasphase umschließen, in die Druck-Temperatur-Ebene. Da bei miteinander im Gleichgewicht stehenden koexistierenden Phasen Druck und Temperatur dieselben Werte annehmen müssen,[6] liegen Siedekurve und Kondensationskurve in der Druck-Temperatur-Ebene übereinander und erscheinen als Linie, die Tripelpunkt und kritischen Punkt verbindet. Die Dampfduckkurve ist daher eine Projektion des Koexistenzgebietes der Gasphase und der flüssigen Phase in die Druck-Temperatur-Ebene.
Feststoff → Flüssigkeit:
- Schmelzkurve; Synonyme: Schmelzlinie, Schmelzpunktskurve, Schmelzdruckkurve
- Bezeichnung des Phasenübergangs: Schmelzen
- Bezeichnung der Zustände während des Phasenübergangs: Schmelzpunkt/Schmelzbereich
Flüssigkeit → Feststoff:
- Erstarrungskurve; Synonyme: Erstarrungslinie, Gefrierpunktskurve, Gefrierpunktslinie
- Bezeichnung des Phasenübergangs: Gefrieren
- Bezeichnung der Zustände während des Phasenübergangs: Gefrierpunkt/Gefrierbereich
Feststoff → Gas:
- Sublimationskurve; Synonyme: Sublimationslinie
- Bezeichnung des Phasenübergangs: Sublimation
- Bezeichnung der Zustände während des Phasenübergangs: Sublimationspunkt/Sublimationsbereich
Gas → Feststoff:
- Resublimationskurve
- Bezeichnung des Phasenübergangs: Resublimation
- Bezeichnung der Zustände während des Phasenübergangs: Resublimationspunkt/Resublimationsbereich
Entmischung:
- Die bei Entmischung einer homogenen Mischphase zu überquerende Phasengrenzlinie wird üblicherweise als Binodale bezeichnet, ohne dabei die Art des Phasenüberganges näher zu spezifizieren.
Einzelnachweise
- Klaus Stierstadt: Thermodynamik (= Springer-Lehrbuch). Springer-Verlag, Berlin/Heidelberg 2010, ISBN 978-3-642-05097-8, doi:10.1007/978-3-642-05098-5. Siehe Kapitel 9, Abbildung 9.5.
- Burkhard Lohrengel: Thermische Trennverfahren: Trennung von Gas-, Dampf- und Flüssigkeitsgemischen. 3. Auflage. Walter de Gruyter, Berlin 2017, ISBN 978-3-11-047352-0. Siehe Kapitel „4.4.2 Teilweise Löslichkeit von Trägerstoff und Extraktionsmittel“.
- J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: Definitions of terms relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1994, S. 577–594, doi:10.1351/pac199466030577.
- Pablo G. Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1, S. 69 ff.
- Schmidt, Joachim.: Einstieg in die Physikalische Chemie für Nebenfächler. 3., überarbeitete und erweiterte Auflage. Vieweg+Teubner Verlag / GWV Fachverlage GmbH, Wiesbaden, Wiesbaden 2009, ISBN 978-3-8348-9256-0, S. 31.
- Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4, doi:10.1017/CBO9781139167604, S. 184.