Diphenylmethan
Diphenylmethan ist eine organische chemische Verbindung aus der Gruppe der aromatischen Kohlenwasserstoffe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
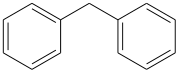 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diphenylmethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C13H12 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristallnadeln mit fruchtig-herbem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse |
Antiparasitäres Mittel | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 168,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,01 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
264 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (14 mg·l−1 bei 25 °C).[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Durch Grignard-Addition von Phenylmagnesiumchlorid an Benzylchlorid oder Reduktion von Benzophenon kann Diphenylmethan einfach in Labormengen hergestellt werden.
Für technische Zwecke sind diese Methoden unwirtschaftlich bzw. schwer handhabbar. Diphenylmethan (3) kann durch elektrophile Substitutionsreaktion von Benzol (1) mit Benzylchlorid (2) in Gegenwart einer Lewis-Säure wie amalgamiertem Aluminium gewonnen werden.[4]
Gegenüber Benzylchloriden ist ansonsten übliches Aluminiumtrichlorid als Katalysator schlecht geeignet;[5] vorteilhaft sind Eisenverbindungen wie Pyrit[6] oder Eisen(III)-chlorid.
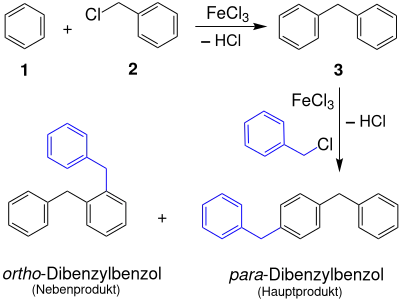
Das bei dieser Synthesereaktion gebildete Diphenylmethan wird anschließend abdestilliert und durch Umkristallisation gereinigt.
- Dibenzylbenzol
Ein Großteil geht jedoch durch Folgereaktion in Form von – vorwiegend – para-Dibenzylbenzol verloren und verbleibt als nicht destillierbarer Rückstand. Dieser Rückstand kann mit stöchiometrischen Mengen an Aluminiumtrichlorid als „Disproportionierings-Katalysator“[7] und überschüssigem Benzol zu Diphenylmethan umgewandelt werden.[8]
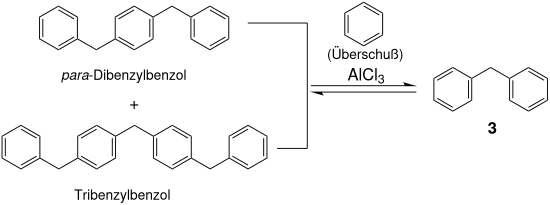
Diese Folgereaktion, die wiederholte Substitution von Benzylchlorid in para-Stellung, führt zu „linearen Polybenzylen“.[9]
Eigenschaften und Verwendung
Wegen seines niedrigen Schmelzpunktes von 26 °C kann Diphenylmethan bei Raumtemperatur entweder als Feststoff oder als Flüssigkeit vorliegen, wobei Verunreinigungen den Schmelzpunkt herabsetzen können. Als Feststoff liegt es in Form von farblosen Kristallnadeln vor, bei Temperaturen oberhalb des Schmelzpunktes als klare Flüssigkeit. Die Verbindung hat einen herb fruchtigen Geruch, ist brennbar, aber schwer entzündbar.[2]
Diphenylmethan wird als dielektrische Flüssigkeit in der Elektrotechnik,[10] als schwerflüchtiges Lösungsmittel für chemische Synthesen[11] und Farbstoffe, Farbträger beim Bedrucken mit Dispersionsfarbstoffen, als Zusatz in Düsentreibstoffen, für die Seifenparfümierung und als Fixateur in der Geruchsstoffindustrie verwendet.
Pharmakologische Bedeutung
Trizyklische Diphenylmethan-Derivate wurden ab den 1960er Jahren als Antidepressiva eingesetzt.[12]
Siehe auch
Literatur
Einzelnachweise
- Eintrag zu DIPHENYL METHANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Oktober 2021.
- Eintrag zu CAS-Nr. 101-81-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Dezember 2015. (JavaScript erforderlich)
- Beilstein (Syst.Nr. 479), Bd. 5: H 588, EII 498.
- W. W. Hartman and Ross Phillips: Diphenylmethane In: Organic Syntheses. 14, 1934, S. 34, doi:10.15227/orgsyn.014.0034; Coll. Vol. 2, 1943, S. 232 (PDF).
- G. Drechsler, E. Gerull: Eignung verschiedener FRIEDEL-CRAFTS-Katalysatoren zur Polybenzylbenzolsynthese, in: Journal für Praktische Chemie 26, 24–31 (1964), doi:10.1002/prac.19640260104.
- J. A. Smythe: Use of Iron Pyrites in a Friedel-Crafts’ Reaction, in: J. Org. Chem. 121, 1270–1278 (1922).
- Verwendung auch zur Isomerisierung bei anderen Arylbenzylen, z. B. und .
- R. Scholl und C. Seer: Abspaltung aromatisch gebundenen Wasserstoffes unter Verknüpfung aromatischer Kerne durch Aluminiumchlorid, 6. Mitteilung: Versuche mit Phenol-äthern und mit Diphenyl-methan, in: Berichte der deutschen chemischen Gesellschaft 55, 330–341 (1922), doi:10.1002/cber.19220550209. – o-Dibenzylbenzol Smp. 78–79°C, p-Dibenzylbenzol Smp. 86–87°C (S. 336) sowie bei J. A. Smythe.
- J. Skura, R. W. Lenz: Lineare Polybenzyle, 6. Polymerisation von α-Methylbenzylchlorid, in: Makromolekulare Chemie 182, 47–58 (1981), doi:10.1002/macp.1981.021820107. – Die para-Substitution ist zu >70% bevorzugt.
- Liste handelsüblicher Dielektrika
- Patent DE10015840, angemeldet 30. März 2000.
- Gustav Ehrhart/Heinrich Ruschig: Arzneimittel, 1968, Seite 446 f.
