Photoinitiator
Photoinitiatoren sind chemische Verbindungen, die nach Absorption von (UV-) Licht in einer Photolysereaktion zerfallen und so reaktive Spezies bilden, die eine Reaktion starten (initiieren) können (meist eine Polymerisation). Bei den reaktiven Spezies handelt es sich um Radikale oder um Kationen.
Photoinitiatoren werden meist nach Art der reaktiven Spezies eingeteilt (kationisch, radikalisch), manchmal auch nach molarer Masse (niedermolekular oder polymer).

Verwendung
Photoinitiatoren sind Bestandteile von strahlungshärtenden Lack- und Harz-Formulierungen, die in Sekundenbruchteilen durch Bestrahlung mit UV-Licht ausgehärtet werden können. Sie werden zum Beispiel in der Diazotypie, der Stereolithografie und dem Multi Jet Modeling eingesetzt. Für Beschichtungen sind die größten Marktsegmente die Möbel- und Parkettlackierung sowie Druckfarben. Auch in der LCD-Fertigung können Photoinitiatoren eingesetzt werden.[1]
Die Polymerisation eines strahlenhärtenden Systems (z. B. eines Lacks) kann entweder mit Hilfe eines Initiators oder direkt durch Elektronenstrahlen erfolgen. UV-Strahlung, die stark genug wäre, um die radikalische Polymerisation der Monomere (bzw. Oligomere) direkt zu initiieren, besitzt nur eine geringe Eindringtiefe und kann daher nicht eingesetzt werden. Stattdessen werden Radikale aus Photoinitiatoren mit Hilfe langwelligerer UV-Strahlung (254–400 nm) erzeugt, die eine größere Eindringtiefe besitzt.[2][3]
Bei der Wahl des Photoinitiators muss das Absorptionsspektrum des Initiators mit dem Emissionsspektrum der Lichtquelle verglichen werden.
Einteilung nach reaktivem Zentrum
Radikalische Photoinitiatoren
Photoinitiatoren für die radikalische Kettenreaktion werden in zwei Typen unterteilt. Typ-1-Photoinitiatoren erzeugen Radikale direkt in einer Photofragmentation, meist durch alpha-Spaltung. Das gebildete Radikal löst dann die Kettenpolymerisation aus. Typ-2-Photoinitiatoren hingegen abstrahieren ein Wasserstoffatom von einem benachbarten Molekül. Dieses löst dann die Kettenpolymerisation aus. Meist werden tertiäre Amine zugegeben, da diese besonders effektive Startradikale bilden und somit die Reaktivität erhöhen.[2][3]
Häufig industriell eingesetzte Photoinitiatoren leiten sich von α-Hydroxy-, α-Alkoxy- oder α-Amino-Arylketonen oder auch von Acylphosphinoxiden ab. Vereinzelt finden sich auch Anwendungen für photolabile aliphatische Azoverbindungen, die sowohl thermisch als auch photochemisch zerfallen können.
Kationische Photoinitiatoren
Kationische Photoinitiatoren erzeugen bei Zerfall eine Brönsted- oder eine Lewis-Säure. Sie können je nach thermischer Stabilität (thermolatent oder thermisch labil) eingeteilt werden.
Thermolatente Photoinitiatoren
Polymerisationsauslösende Radikale lassen sich bereits durch einfache Verbindungen wie Peroxide oder Disulfide durch Bestrahlung unter homolytischer Bindungsspaltung erzeugen. Für industrielle Anwendungen muss sich der verwendete Photoinitiator jedoch längere Zeit (Monate bis Jahre) vor der Anwendung in Monomeren aufgelöst lagern lassen, ohne dass es zu einer Polymerisation (Gelierung) kommt. Bei Bestrahlung muss es dann mit hoher Quantenausbeute und frei von Nebenreaktionen die Polymerisation starten. Aus diesem Grund sind AIBN, Peroxide oder Disulfide für industrielle Anwendungen kaum geeignet. Aus diesem Grund wurden thermolatente Photoinitiatoren entwickelt, die stabil gegenüber Wärme sind (Thermolatenz) und sich daher zuvor längere Zeit unter Lichtausschluss in Monomeren aufgelöst lagern lassen. Zudem besitzen sie optimierte Absorptionsspektren, damit sie unter verschiedenen Anwendungsbedingungen eingesetzt werden können.
Thermolatente Photoinitiatoren werden besonders zur kationischen Polymerisation von Epoxidharzen benutzt, wobei cycloaliphatische Epoxidharze hier reaktiver sind als Glicidylepoxidharze. Die meisten solcher thermolatenten Photoinitiatoren sind Onium-Verbindungen.[4][5]
Geschichte
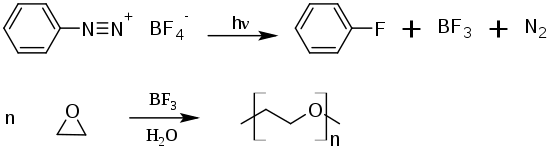
In den 1970er Jahren war es das Ziel der industriellen Lackforschung, als Alternativen zur energieaufwändigen thermischen Härtung (welche den Betrieb großer Öfen erfordert), die Strahlenhärtung als ökonomische Alternative zu etablieren. Die erste, wichtige Entdeckung in dieser Richtung machten Mitarbeiter der American Can Company. Sie fanden, dass die Photosensitivität von Aryldiazonium-Salzen zur kationischen Polymerisation von Epoxiden genutzt werden kann:[5]
Das Aryldiazoniumsalz zersetzt sich unter Bildung der Lewis-Säure Bortrifluorid, welche die kationische Polymerisation initiiert.
Da Aryldiazoniumsalze jedoch thermisch instabil sind, führt eine Beimischung von Initiator zu Monomer (eine Formulierung) auch in Abwesenheit von Licht oft nach wenigen Stunden zu Gelierung. Ein weiterer Nachteil der Aryldiazoniumsalze ist die Bildung von (gasförmigem) Stickstoff, was zu Defekten im ausgehärteten Lack führen kann. Daher erlangen die Aryldiazoniumsalze zwar keine kommerzielle Bedeutung, die Entdeckung führte aber zur Erkenntnis, dass photosensible, organische Verbindungen zur Initiation kationischer Polymerisation in der Lage sind und damit zu intensiver Forschung in diese Richtung. Dabei wurden bald die Onium-Verbindungen als effiziente Photoinitiatoren entdeckt, diese werden bis heute verwendet. Onium-Verbindungen besitzen nicht mehr die Nachteile der Aryldiazoniumsalze, sondern verfügen über gute thermische Stabilität (also Thermolatenz) und setzen bei ihrer Spaltung keine gasförmigen Produkte frei. Zudem besitzen sie intensive Absorption im kurzwelligen UV-Bereich und eine gute Quantenausbeute. Zunächst wurden die Diaryliodoniumsalze entdeckt, später folgten die thermisch besonders stabilen Triarylsulfoniumsalze. Diese besaßen zudem den Vorteil, dass sie zu dieser Zeit bereits als Korrosionsinhibitoren hergestellt und damit günstig verfügbar waren.[5]
Traditionelle kationische Initiatoren (Lewis- oder Brönstedsäuren) führen zu sofortiger Polymerisation. Industriell ist jedoch eine lagerfähige Formulierung erwünscht, deren Polymerisation durch einen externen Stimulus (UV-Strahlung) ausgelöst werden kann. Die kommerzielle Nutzung der kationischen Vernetzung wurde daher erst durch die Entwicklung der Onium-Photoinitiatoren möglich.[5]
Industrielle Verwendung
Prinzipiell lässt sich fast jedes kationisch polymerisierbare Polymer mit Onium-Verbindungen als Initiator herstellen, meist werden die Onium-Verbindungen jedoch zur Herstellung vernetzter Polymere genutzt, meist Epoxiden. Mittels photokationischer Epoxidpolymerisation lassen sich sowohl hohe Polymerisationsgeschwindigkeiten auch bei niedriger Temperatur erreichen, wie auch präzise Vernetzung durch selektive Bestrahlung. Die Hauptanwendungsgebiete sind daher photohärtende Beschichtungen, Beschichtungen in Mikroelektronik und Stereolitographie, Druckfarben und Klebstoffe.[5]
Es existieren zahlreiche Klassen von thermolatenten Photoinitiatoren, einige typische Vertreter sind in der folgenden Tabelle aufgeführt. Wie zu erkennen ist, gehören die meisten zur Klasse der Onium-Verbindungen.[5]
| Klassenname | Strukturformel |
|---|---|
| Aryldiazonium | 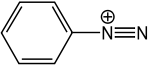 |
| Diaryliodonium | 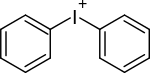 |
| Triarylsulfonium | 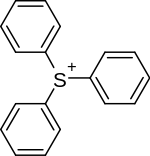 |
| Ferrocenium | 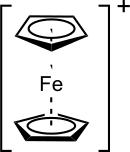 |
| Phenacyltriphenylphosphonium | 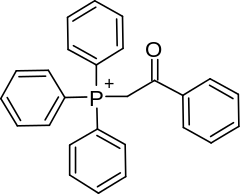 |
| N-Alkoxypyridinium | 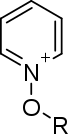 |
| Pyrylium | 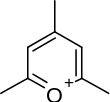 |
| Thiapyrilium | 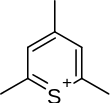 |
Einteilung nach molarer Masse
Während Photoinitiatoren für gewöhnlich niedermolekular sind, gibt es auch (kationische) Photoinitiatoren, die an ein Polymer gebunden sind. Ein Vorteil ist, dass ein solcher (hochmolekularer) Photoinitiator nicht in seine Umgebung migriert und daher untoxisch ist. Ein weiterer Vorteil ist, dass er eine Polymerisationsreaktion ab dem bereits vorhandenen Polymer startet und so zu einem höheren Vernetzungsgrad führt.[6]
Gesundheitliche Gefahren
2009 haben mehrere Behörden für Lebensmittelsicherheit in trockenen Lebensmitteln z. B. Getreideprodukten Photoinitiatoren entdeckt. Auf Grund der sehr geringen Größe der Moleküle der Photoinitiator können diese von der Bedruckten Seite von Lebensmittelverpackungen auch durch mehrere Schichten Verpackung (z. B. Papier, Pappe oder Kunststoff) in die Lebensmittel übergehen. Die Grenzwerte wurden bei Kontrolluntersuchungen zwar zumeist unterschritten, da allerdings für jede Art von Photoinitiator ein eigener Grenzwert gegeben ist und keine Addition stattfindet, kann eine erhebliche Menge an Substanzen in den Lebensmitteln ohne Beanstandung vorhanden sein. Die gesundheitlichen Auswirkungen werden zumeist als kritisch angesehen. Zwei Photoinitiatoren Benzophenon und 4-Methylbenzophenon wurden in Tierversuchen als schädlich eingestuft, andere bisher nicht getestet. Diese beiden Stoffe können Geschwüre an Leber und Niere verursachen. Der zulässige Grenzwert liegt bei 0,6 Mikrogramm pro Kilogramm Lebensmittel. Der Grenzwert wurde bei einigen getesteten Lebensmitteln leicht überschritten.[7][8]
Literatur
- Eintrag zu Photoinitiatoren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Dezember 2014.
- R. Schwalm: UV-Coatings – Basics, Recent Developments and New Applications. Elsevier, 2007, ISBN 978-0-444-52979-4.
- Dieter Stoye, Günter Beuschel: Lackharze: Chemie und Eigenschaften und Anwendungen. Hanser Verlag, 1996, ISBN 3-446-17475-3, S. 93 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
Einzelnachweise
- Forschungspreis 2005 von Ciba Spezialitätenchemie für neue Photoinitiatoren-Technologie für LCDs
- Stefan Pieke: Experimentelle Untersuchungen zur effizienten Vernetzung von Oberflächenbeschichtungen mit UV-Strahlung. Karlsruher Institut für Technologie, Karlsruhe 2010, ISBN 978-3-86644-452-2, S. 10–22, doi:10.5445/KSP/1000014055.
- Norman S. Allen: Photoinitiators for UV and visible curing of coatings: Mechanisms and properties. In: Journal of Photochemistry and Photobiology A: Chemistry. Band 100, Nr. 1, 25. Oktober 1996, S. 101–107, doi:10.1016/S1010-6030(96)04426-7.
- Yusuf Yağci, Ivo Reetz: Externally stimulated initiator systems for cationic polymerization. In: Progress in Polymer Science. 23, Nr. 8, Dezember 1998, S. 1485–1538. doi:10.1016/S0079-6700(98)00010-0.
- Verena Görtz: Benzothiazoliumsalze als Photoinitiatoren für kationische Polymerisation 2005. online (Memento des Originals vom 19. Dezember 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- W. Arthur Green: Industrial Photoinitiators: A Technical Guide. CRC Press, 2010, ISBN 978-1-4398-2746-8, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).
- SR-online: Druckchemie in Lebensmitteln (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Ausmaß der Migration von Druckfarbenbestandteilen aus Verpackungsmaterialien in Lebensmittel (PDF; 859 kB), 29. Mai 2011.