Anisaldehyd
Anisaldehyd ist eine aromatische Verbindung, leitet sich strukturell von Benzaldehyd bzw. Anisol ab und gehört zur Stoffgruppe der Methoxybenzaldehyde.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
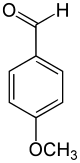 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Anisaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 136,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,12 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
247–249 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (2 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,5731[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
In der Natur kommt Anisaldehyd in Sternanis,[4] Anis, Fenchel und anderen ätherischen Ölen vor. Er wird in Pflanzen über den Shikimisäureweg synthetisiert.
Gewinnung und Darstellung
Anisaldehyd kann durch Oxidation (z. B. durch Salpetersäure oder Chromsäure) von Anethol oder 4-Methoxytoluol oder aus Anisol durch eine Vilsmeier-Reaktion gewonnen werden.
Eigenschaften
Durch Umsetzung von Anisaldehyd mit Oxidationsmitteln (z. B. Fehling- oder Silberspiegelprobe) lässt sich Anissäure (p-Methoxybenzoesäure) darstellen.
Verwendung
Anisaldehyd wird als Zwischenprodukt zur Synthese von Arzneistoffen, Duftstoffen und anderer Chemikalien verwendet.
Anisaldehyd dient in der Dünnschichtchromatographie in Form eines Sprühreagenz zum Nachweis von diversen Naturstoffklassen (insbesondere Terpenderivaten). Dazu werden 0,5 mL Anisaldehyd mit 10 mL Eisessig, 85 mL Methanol und 5 mL konz. Schwefelsäure in der angegebenen Reihenfolge gemischt. Nach dem Aufsprühen dieser Lösung auf die DC-Platte und anschließendem Erhitzen der Platte auf ca. 110 °C für 5 bis 10 Minuten färben sich die entsprechenden Zonen im Tageslicht charakteristisch.[5] Dieses Reagenz wird unter der Bezeichnung Anisaldehyd-Reagenz R im Europäischen Arzneibuch (Ph. Eur.) gelistet.[6] Das Reagenz ist nur für eine begrenzte Zeit haltbar. Beim Auftreten einer Rot-Violettfärbung ist es zu verwerfen.[5]
Sicherheitshinweise
Die Dämpfe von Anisaldehyd können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 116 °C, Zündtemperatur 220 °C)[2] bilden.
Einzelnachweise
- Eintrag zu ANISALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Eintrag zu CAS-Nr. 123-11-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. November 2016. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Jayanta Kumar Patra, Gitishree Das, Sankhadip Bose, Sabyasachi Banerjee, Chethala N. Vishnuprasad, Maria Pilar Rodriguez‐Torres, Han‐Seung Shin: Star anise (Illicium verum): Chemical compounds, antiviral properties, and clinical relevance. In: Phytotherapy Research. Band 34, Nr. 6, Juni 2020, S. 1248–1267, doi:10.1002/ptr.6614.
- Egon Stahl, Werner Schild: Isolierung und Charakterisierung von Naturstoffen. 1. Auflage. Gustav Fischer Verlag, Stuttgart/New York 1986, ISBN 3-437-30511-5, S. 173.
- Europäisches Arzneibuch. 4.00 Auflage. Band 1. Deutscher Apotheker Verlag/Govi-Verlag – Pharmazeutischer Verlag GmbH, Stuttgart/Eschborn 2002, ISBN 3-7692-2947-9, S. 384.