δ-Aminolävulinsäure-Dehydratase
δ-Aminolävulinsäure-Dehydratase (ALAD) oder auch Porphobilinogen-Synthase ist der Name des Enzyms in vielen Lebewesen, das zwei Moleküle δ-Aminolävulinsäure (ALA) zu einem Molekül Porphobilinogen zusammenbaut. Es ist damit ein unverzichtbarer Teil der Porphyrinbiosynthese, jener Teil des menschlichen Stoffwechsels, der den Blutfarbstoff Hämoglobin herstellt. Ein Mangel an ALAD beim Menschen, der durch Mutation am ALAD-Gen hervorgerufen wird, führt zur Porphyrie. Der Gehalt an ALAD im Blut ist erniedrigt bei einer Bleivergiftung,[1][2] als Folge tritt ein erhöhter Spiegel von ALA in Blut und Urin auf.[3]
| Δ-Aminolävulinsäure-Dehydratase | ||
|---|---|---|
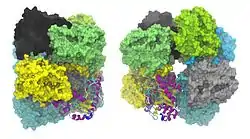 | ||
| Oberflächenmodell des ALAD-Octamers von zwei Seiten, eine Untereinheit als Bänder, nach PDB 1E51 und PISA. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 36,3 kDa / 330 Aminosäuren (Isoform 1)
39,0 kDa / 359 Aminosäuren (Isoform 2) | |
| Sekundär- bis Quartärstruktur | Homooctamer | |
| Kofaktor | Zn2+ | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Namen | ALAD ; ALADH; PBGS | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.2.1.24, Lyase | |
| Reaktionsart | Kondensation | |
| Substrat | 2 δ-Aminolävulinsäure | |
| Produkte | Porphobilinogen + 2 H2O | |
| Vorkommen | ||
| Homologie-Familie | 5-ALAD | |
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Haumaus | |
| Entrez | 210 | 17025 |
| Ensembl | NSG00000148218 | ENSMUSG00000028393 |
| UniProt | P13716 | P10518 |
| Refseq (mRNA) | NM_000031 | NM_00127644 |
| Refseq (Protein) | NP_000022 | NP_001263375 |
| Genlocus | Chr 9: 113.39 – 113.4 Mb | Chr 4: 62.51 – 62.52 Mb |
| PubMed-Suche | 210 | 17025 |
Jede der acht identischen Untereinheiten des Enzyms bindet als Cofaktor ein Zinkion. In einem ähnlichen Pflanzenenzym ist Zink durch Magnesium ersetzt.[4]
Katalysierte Reaktion
![]() +
+ ![]()
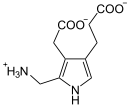 + 2 H2O
+ 2 H2O
Zwei ALA-Moleküle kondensieren zu Porphobilinogen.
Weblinks
- Jassal, D'Eustachio / reactome: ALA is transported from the mitochondrial matrix to the cytosol
- Jassal, D'Eustachio / reactome: Two molecules of ALA condense to form porphobilinogen (PBG)
- Jassal, D'Eustachio / reactome: ALAD octamer associates with Pb++, forming a catalytically inactive complex
Einzelnachweise
- UniProt-Eintrag
- Δ-Aminolävulinsäure-Dehydratase. In: Online Mendelian Inheritance in Man. (englisch).
- Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 978-3-13759403-1, S. 192.
- PROSITE PDOC00153