3,9-Divinyl-2,4,8,10-tetraoxaspiro(5.5)undecan
3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan, kurz DVTOSU, ist ein bicyclisches organisches Molekül mit einem zentralen quartären Kohlenstoffatom, dem Spiroatom, mit dem zwei jeweils noch fünf Atome umfassende alicyclische Ringe verknüpft sind. Die so entstehende Spiroverbindung ist nach der von Adolf von Baeyer vorgeschlagenen Nomenklatur[6] ein Spiro[5.5]undecan, bzw. wegen der vier enthaltenen Sauerstoffatome ein 2,4,8,10-Tetraoxaspiro[5.5]undecan, das in 3- und 9-Stellung je eine Allylgruppe trägt. DVTOSU ist ein Diallylacetal und die Vorstufe für das isomere Ketenacetalmonomer 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan, kurz DETOSU, das einen Baustein für Polyorthoester darstellt.[7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
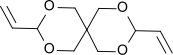 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C11H16O4 | |||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 212,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Erstmals wurden Kondensationsprodukte aus Acrolein und Pentaerythrit im Jahr 1950 beschrieben.[2][8] Die Synthese verläuft nach der allgemeinen Herstellungsvorschrift für Acetale bei saurem pH (pH 3–5) durch Umsetzung eines Alkohols mit einem Überschuss an Aldehyd, der im Fall des bei erhöhter Temperatur zur Polymerisation neigenden Acroleins mit Hydrochinon stabilisiert wird.
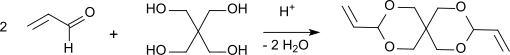
Nach 19 Stunden Erhitzen unter Rückfluss, Neutralisation der Oxalsäure, Abziehen des überschüssigen Aldehyds und des Reaktionswasser wird der Rückstand unter Vakuum fraktioniert und 87 % d.Th. Diallylidenpentaerythrit erhalten. Nach Umkristallisation aus 60%igem Methanol wird reines DVTOSU in 79%iger Ausbeute mit einem Siedepunkt von 108–110 °C bei 2 Torr und einem Schmelzpunkt von 42–42 °C erhalten. Der Grad der Umsetzung zum Acetal ist bestimmt durch die Gleichgewichtskonstante der Reaktion:
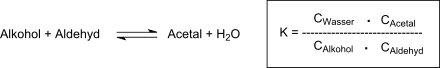
Die gebräuchlichste Technik zur Vervollständigung der Acetalbildungsreaktion ist die Entfernung des Reaktionswassers durch azeotrope Destillation mit organischen Lösungsmitteln, die nicht mit Wasser mischbar sind, wie z. B. Benzol oder Toluol. Neben der Polymerisationsneigung des Acroleins bei erhöhter Temperatur macht seine hohe Flüchtigkeit bei höheren Temperaturen Probleme, wie sie für die Entfernung des Wassers erforderlich sind. Die geringen Raum-Zeit-Ausbeuten der Acetalbildungsreaktion erfordern lange Reaktionszeiten bei erhöhten Temperaturen, bei denen auch die nucleophile Addition von Wasser und Alkohol an die Doppelbindung des ungesättigten Aldehyds zu unerwünschten Nebenprodukten führt. Die Anpassung der Reaktionsbedingungen an diese Erfordernisse ermöglicht die Herstellung von DVTOSU in 80%iger Ausbeute nach 50 Min. Reaktionszeit bei 80 °C Reaktionstemperatur und 20%igem Aldehydüberschuss.[4] Die Entfernung des Reaktionswassers durch azeotrope Destillation mit Benzol als (Schleppmittel) verkürzt die Reaktionszeit auf 10h, wobei nach fraktionierter Destillation DVTOSU in einer Ausbeute von 75 % d.Th. mit einem Siedepunkt von 138–141 °C bei 12 mm HG erhalten werden.[5] Auch unter sehr schonenden (Raumtemperatur) und kontinuierlichen Prozessbedingungen können 1,3-Diole mit Acrolein zu cyclischen Acetalen durch kontinuierliche Extraktion mit z. B. n-Hexan in Ausbeuten bis zu 90 % erzeugt werden.[9]
Eigenschaften
3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan ist im Reinzustand ein weißes, kristallines Pulver.[1] Wegen seiner geringen Kristallisationsneigung kommt DVTOSU oft als Flüssigkeit in den Handel.[10] Die stark schwankenden Angaben zu den Ausbeuten und Siedepunkten bei der ersten fraktionierten Destillation weisen auf Nebenreaktionen bzw. Nebenprodukte, z. B. durch Umlagerung der Doppelbindungen oder nucleophile Addition hin. Die Darstellung des reinen DVTOSU als Feststoff erfordert mehrmaliges Umkristallisieren aus Kohlenwasserstoffen, z. B. Pentan oder n-Hexan oder wässrigem Methanol.
Verwendung
Alkohole, wie z. B. Methanol, und Säuren, wie z. B. Essigsäure können in einer nucleophilen Additionsreaktion an die allylische Doppelbindungen des Diallylidenpentaerythrits zum entsprechenden 3,9-Dimethoxyethyl- bzw. 3,9-Diacetoxyethyl-2,4,8,10-tetraoxaspiro[5.5]undecan angelagert werden.[2] Ebenso addieren sich Chlorwasserstoff in 80%iger Ausbeute oder Cyanwasserstoff in 50%iger Ausbeute zum entsprechenden 3,9-Bis(2-chlorethyl)- bzw. 3,9-Bis(2-cyanoethyl)-2,4,8,10-tetraoxaspiro[5.5]undecan.[4] Diallylidenpentaerythrit reagiert in Gegenwart starker Säuren, wie z. B. Bortrifluoriddiethyletherat, mit Diolen oder Disäuren zu gummiartigen Polymeren, die unter weiterer Säurezugabe und erhöhten Temperaturen zu harten Harzen vernetzt werden können.[3] Nach Angaben der Autoren werden die terminalen C-Atome der Allylgruppen des DVTOSU über Etherbindungen mit dem Di- bzw. Polyol verknüpft. Das Diallylacetal 3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan, DVTOSU, ist Ausgangsverbindung für das Ketendiacetal 3,9-Diethyliden-2,4,8,10-tetraoxaspiro[5.5]undecan, DETOSU, das durch Verschiebung der Doppelbindungen von der Allyl- in die Vinylposition entsteht.[5]
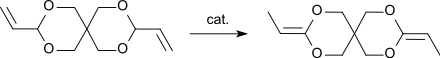
DETOSU hat als reaktives Monomer zur Bildung von Polyorthoestern Bedeutung.
Einzelnachweise
- Eintrag zu 3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecane bei TCI Europe, abgerufen am 28. Juli 2014.
- H. Schulz, H. Wagner: Synthese und Umwandlungsprodukte des Acroleins. In: Angewandte Chemie. Band 62, Nr. 5, 1950, S. 105–118, doi:10.1002/ange.19500620502.
- Frank Brown, D. E. Hudgin, R. J. Kray: Polymers from the Unsaturated Bisacetals of Pentaerythritol. In: Journal of Chemical & Engineering Data. Band 4, Nr. 2, 1959, S. 182–187, doi:10.1021/je60002a020 (PDF (Memento vom 24. September 2015 im Internet Archive)).
- R. F. Fischer, C. W. Smith: Cyclic Acrolein Acetals. In: The Journal of Organic Chemistry. Band 25, Nr. 3, 1960, S. 319–324, doi:10.1021/jo01073a002.
- J. V. Crivello, R. Malik, Y.-L. Lai: Ketene acetal monomers: Synthesis and characterization. In: Journal of Polymer Science Part A: Polymer Chemistry. Band 34, Nr. 15, 1996, S. 3091–3102, doi:10.1002/(SICI)1099-0518(19961115)34:15<3091::AID-POLA1>3.0.CO;2-0.
- Wolfgang Holland: Die Nomenklatur in der organischen Chemie. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1969, S. 81.
- J. Heller, K. J. Himmelstein: Poly (ortho ester) biodegradable polymer systems. In: Methods in enzymology. Band 112, 1985, S. 422–436.
- Patent DE858406: Verfahren zur Herstellung von ungesättigten cyclischen Acetalen. Veröffentlicht am 8. Dezember 1952, Anmelder: Deutsche Gold- und Silber-Scheideanstalt vormals Roessler, Erfinder: H. Wagner.
- Patent US4108869: Preparation of an acetal from a diol and acrolein. Veröffentlicht am 22. August 1978, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: H. B. Copelin.
- Datenblatt 3,9-Divinyl-2,4,8,10-tetraoxaspiro[5.5]undecan bei Sigma-Aldrich, abgerufen am 20. Juli 2014 (PDF).