2-Ethylhexan-1,3-diol
2-Ethylhexan-1,3-diol (auch vereinfacht Ethylhexandiol) ist eine Mischung mehrerer isomerer organisch chemischer Verbindungen aus der Gruppe der Alkandiole.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
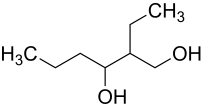 | ||||||||||||||||||||||
| Strukturformel ohne Angabe zur Stereoisomerie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2-Ethylhexan-1,3-diol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H18O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,22 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
0,94 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
243 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4497[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Stereochemie
Das Molekül weist zwei Stereozentren auf, am 2. und am 3. Kohlenstoff, so dass vier stereoisomere Verbindungen vom Ethylhexandiol existieren:
- (2R,3R)-2-Ethylhexan-1,3-diol
- (2S,3S)-2-Ethylhexan-1,3-diol
- (2R,3S)-2-Ethylhexan-1,3-diol
- (2S,3R)-2-Ethylhexan-1,3-diol
Darstellung
Die Synthese von Ethylhexandiol kann durch Kondensation von Butanal mit Magnesiumaluminiumethoxid und anschließender Hydrolyse des entstandenen Esters erfolgen. Ein anderer Ansatz ist die Hydrierung von Butyraldol (2-Ethyl-3-hydroxyhexanal). Ausgangsverbindungen der industriellen Produktion sind Chemikalien der Petrochemie.
Verwendung
Es wird als Gemisch der vier stereoisomeren Formen als Repellent gegen Insekten (besonders wirksam gegen Aedes)[5], Kühlschmiermittel und als Emolliens verwendet.[3]
Siehe auch
Einzelnachweise
- Eintrag zu ETHYL HEXANEDIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu 2-Ethylhexan-1,3-diol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Werner Baumann, Thomas Rothardt: Druckereichemikalien. Springer, Berlin/Heidelberg 1999, ISBN 3-540-66046-1, S. 935 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu 2-ethylhexane-1,3-diol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Military Preventive Medicine: Mobilization and Deployment, Vol 1. Kapitel 22: Personal Protection Measures Against Arthropods, S. 508.
