2-Acrylamido-2-methylpropansulfonsäure
2-Acrylamido-2-methylpropansulfonsäure (Warenzeichen von Lubrizol: AMPS) ist eine chemische Verbindung aus der Gruppe der Sulfonsäuren. Die auch als 2-Acrylamido-tert-butylsulfonsäure (ATBS) bezeichnete Verbindung ist ein sehr reaktionsfähiges und gut wasserlösliches Acrylmonomer, das hochmolekulare Homopolymere (Molekülmasse >2 Mio.[5]) mit außergewöhnlichen Produkteigenschaften bildet und mittels radikalischer Copolymerisation mit anderen Monomeren zur gezielten Hydrophilierung der erhaltenen Copolymeren eingesetzt wird. Ursprünglich zur Verbesserung der Anfärbbarkeit von Polyacrylnitril-Fasern vorgeschlagen, hat AMPS aufgrund seiner Funktionalität breiten Einsatz in einer Vielzahl von Anwendungen gefunden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
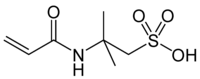 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Acrylamido-2-methylpropansulfonsäure | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C7H13NO4S | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 207,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,1 g·cm−3 (15,6 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser (1500 g·l−1 bei 25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Es wird nur synthetisch hergestellt. Ein natürliches Vorkommen ist nicht bekannt.
Herstellung
2-Acrylamido-2-methylpropansulfonsäure entsteht in einer Ritter-Reaktion aus Acrylnitril und Isobuten in Gegenwart hochkonzentrierter oder rauchender Schwefelsäure und Wasser[6]. Die neuere Patentliteratur[7] beschreibt diskontinuierliche und kontinuierliche Prozesse, die AMPS in hoher Reinheit (bis 99,7 %) und verbesserter Ausbeute (bis 89 %, bezogen auf Isobuten) bei Zugabe von flüssigem Isobuten zu einem Acrylnitril/Schwefelsäure/Phosphorsäuregemisch bei 40 °C erzeugen.
Eigenschaften
AMPS ist ein weißer, kristalliner, hygroskopischer Feststoff, der sich sehr gut in Wasser löst und mit Alkali- und Erdalkalimetallen gut lösliche Salze bildet. Wässrige AMPS-Lösungen reagieren wegen der vollständigen Dissoziation der Sulfonsäuregruppe stark sauer. Handelsüblich ist der Feststoff in Pulver- und Granulatform und wässrige 50%ige Lösungen der Natrium- (AMPS-Na) und Ammoniumsalze. AMPS verfügt als Acrylmonomer über ungewöhnliche Stoffeigenschaften, die es insbesondere als Comonomer in funktionellen Polymeren interessant machen:
- Hohe thermische und hydrolytische Stabilität: Die Amidfunktion im AMPS-Molekül ist durch die geminalen Methylgruppen und die Sulfomethylgruppe räumlich abgeschirmt und gegen hydrolytischem und thermischem Abbau geschützt[8]. Die Zersetzung von AMPS-Homopolymeren erfolgt ab 225 °C, von AMPS-Na-Homopolymeren sogar erst ab 307 °C[9].
- Ausgeprägte Hydrophilie und Acidität: Die Sulfonsäurefunktion verleiht AMPS einen permanent hydrophilen Charakter und liegt weit in den sauren pH-Bereich als Sulfonat-Anion vor. Bereits geringe Anteile an AMPS (< 5 Gew.%) erhöhen die Hydrophilie von Copolymeren beträchtlich.
- Gute Löslichkeit: AMPS löst sich sehr gut in Wasser und gut in den aprotisch-dipolaren Lösungsmitteln Dimethylformamid und N-Methyl-2-pyrrolidon.
Die hohe Stabilität des AMPS bedingen seine geringe Bioabbaubarkeit. Es ist nicht mutagen und besitzt als neutrale AMPS-Na-Salzlösung eine sehr geringe Toxizität LD50 >16,000 mg/kg Ratte.[10] Das in der Umwelt vorliegende Anion ist persistent und mobil.[11]
Es polymerisiert leicht, auch unter Einfluss von Licht.
Verwendung
Als Bestandteil von Copolymeren mit Acrylsäure, Acrylamid und anderen funktionellen Acryl- und Vinylmonomeren. AMPS findet eine Reihe von Anwendungen[12] als Additiv oder Comonomer in:
1. Textil: erhöht die Anfärbbarkeit von polyacryl- und polyesterhaltigen Textilien.[13]
2. Farben, Lacke und Papierbeschichtung: bedingt eine höhere chemische und mechanische Stabilität von Polymeremulsionen, stabilisiert die Partikelverteilung, unterdrückt die Griesbildung und erhöht die Abriebfestigkeit von Anstrichen und Papieren.[14]
3. Klebstoffe: verbessert die thermischen und mechanischen Eigenschaften und erhöht die Haftfestigkeit von druckempfindlichen Klebstoffformulierungen.[15]
4. Waschmittel: steigert die Waschwirkung von Tensiden durch Bindung mehrwertiger Kationen und reduziert die Schmutzanlagerung[16].
5. Kosmetik und Medizin: bildet mit anderen Comonomeren hochmolekulare Polymere, die als Hydrogele und in Emulsionen als Verdicker, Stabilisator, Dispergator und Gleitmittel in kosmetischen, dermatologischen und medizinischen Zubereitungen Anwendung finden.[17] Wird wegen seines hohen Wasseraufnahme- und -rückhaltevermögens als Comonomer in Superabsorbern für z. B. Babywindeln eingesetzt.[18]
6. Wasserbehandlung: stabilisiert besonders in Co- und Terpolymeren mit anderen ionischen und neutralen Monomeren mehrwertige Kationen in hartem Wasser und verhindert als 'scale inhibitor' die Kesselsteinbildung und Korrosion[19].
7. Pflanzenschutz: erhöht in gelösten[20] und nanopartikulären[21] Polymerzubereitungen die Bioverfügbarkeit von Pflanzenschutzmitteln in wässrig-organischen Zubereitungen.
8. Membranen: steigert Wasserfluss, Rückhalt und Fouling-Resistenz von asymmetrischen Ultra- und Mikrofiltrationsmembranen[22] und wird als anionische Komponente in polymeren Brennstoffzellmembranen untersucht[23].
9. Bau: wirkt in Copolymeren als Wasserrückhaltemittel in Mörteln und Putzen[24], führt zu zunehmender Dispergierbarkeit von Partikeln, erhöht das Gleitvermögen und verbessert in Copolymeren, insbesondere mit Methacryl- oder Acrylsäure, als Betonverflüssiger[25] die mechanische und chemische Stabilität von hochfließfähigem und selbstverdichtendem Beton.
10. Öl- und Gasexploration: erhöht die Stabilität von Polymeren in Öl- und Gasfeldanwendungen gegenüber hohen Temperaturen und Drücken, sowie hohen Salzkonzentrationen[9], verringert die Reibung und den Flüssigkeitsverlust in Bohr- und Zementierungsflüssigkeiten[26] und findet Anwendung in der tertiären Ölgewinnung[27] und bei dem Hydraulic Fracturing genannten Aufbrechen von Gesteinsformationen zur Förderung von Schiefergas.[28]
Die gegenwärtige Produktionskapazität der drei wichtigsten AMPS-Hersteller beträgt über 30.000 Tonnen/Jahr.[29]
Einzelnachweise
- Eintrag zu 2-ACRYLAMIDO-2-METHYLPROPANE SULFONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- Datenblatt 2-Acrylamido-2-methylpropansulfonsäure (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu 2-Acrylamido-2-methylpropansulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Eintrag zu 2-Acrylamido-2-methylpropanesulfonate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 24. Oktober 2021.
- Vinati Organics Ltd: 2-Acrylamido 2-methylpropanesulfonic Acid (ATBS) (Memento vom 30. Oktober 2010 im Internet Archive)
- Patent US3506707: Preparation of acrylamidoalkanesulfonic acids. Angemeldet am 1. Februar 1968, veröffentlicht am 14. April 1970, Anmelder: Lubrizol Corp., Erfinder: Leonard E Miller, Donald L Murfin.
- US 6,504,050, Erfinder: P.P. Barve et al., Anmelder: CSIR (IN), veröffentlicht am 7. Januar 2003
- W.O. Parker, jr., A. Lezzi, Polymer, 34 (23), 4913–4918 (1993)
- Lubrizol, AMPS(R) Specialty Monomers, Oil Field Applications
- The Lubrizol Corp.: HPV Challenge Program, Test Plan for AMPS (PDF; 1,1 MB), Aug. 1, 2000.
- Isabelle Neuwald, Matthias Muschket, Daniel Zahn, Urs Berger, Bettina Seiwert: Filling the knowledge gap: A suspect screening study for 1310 potentially persistent and mobile chemicals with SFC- and HILIC-HRMS in two German river systems. In: Water Research. Band 204, 1. Oktober 2021, ISSN 0043-1354, S. 117645, doi:10.1016/j.watres.2021.117645 (sciencedirect.com [abgerufen am 4. Dezember 2021]).
- Vinati Organics Ltd., Produktdatenblatt
- EP 1 611 278, Erfinder: W. Brennich et al., Anmelder: CHT R. Beitlich GmbG, erteilt am 24. Januar 2007
- G.P. Marks, A.C. Clark, ACS Symposium Series, 775,(5), 46–53 (2000) und EP 0 973 807, Erfinder: R. Figge, H.-P. Weitzel, Anmelder: Wacker-Chemie GmbH, veröffentlicht am 20. September 2000
- US 4,012,560, Erfinder: J.C. Baatz, A.E. Corey, Anmelder: Monsanto Co., erteilt am 15. März 1977 und WO 2007/057333, Erfinder: A. Hashemzadeh, Anmelder: Wacker Polymer Systems, veröffentlicht am 24. Mai 2007
- US 7,928,047, Erfinder: M.-S. Cho, Anmelder: LG Household & Health Care Ltd., veröffentlicht am 19. April 2011
- EP 1 236 464, Erfinder: M. Löffler et al., Anmelder: Clariant GmbH, veröffentlicht am 4. September 2002 und EP 2 055 315, Erfinder: R. von Eben-Worlée et al., Anmelder: Worlée-Chemie, veröffentlicht am 6. Mai 2009
- WO 2011/131526, Erfinder: N. Herfert et al., Anmelder: BASF SE, veröffentlicht am 27. Oktober 2011
- Z. Amjad, Tenside Surf. Det., 44(4), 202–208 (2007)
- Patent US20110166309: Preparation containing at least one type of fungicidal conazole. Angemeldet am 14. März 2011, veröffentlicht am 7. Juli 2011, Anmelder: BASF, Erfinder: Sebastian Koltzenburg et al..
- EP 1 681 923, Erfinder: S. Koltzenburg et al., Anmelder: BASF AG, veröffentlicht am 20. April 2011
- US 6,183,640, Erfinder: I. Wang, Anmelder: USF Filtration and Separations Group, Inc., erteilt am 6. Februar 2001
- US 2008/020255, Erfinder: H. Hiraoka, T. Yamaguchi, Anmelder: Toagosei Co., Ltd., veröffentlicht am 24. Januar 2008 und H. Diao et al., Macromolecules, 43(15), 6398–6405 (2010)
- EP 0 936 228, Erfinder: G. Albrecht et al., Anmelder: SKW Trostberg AG, veröffentlicht am 18. August 1999 und WO 03/085013, Erfinder: C. Spindler et al., SKW Polymers GmbH, veröffentlicht am 16. Oktober 2003
- "Modern Superplasticizers in Concrete Technology", Verein Deutsche Bauchemie e.V., Frankfurt am Main, January 2007 und Y.-S. Ye et al., J. Appl. Polym. Sci., 100, (3), 2490–2496 (2006) und C.T. Liao et al., Cement and Concrete Research, 36, (4), 650–655 (2006) und A. Buyukyagaci et al., Cement and Concrete Research, 39, (7), 629–635 (2009)
- US 6,448,311, Erfinder: M.L. Walker, Anmelder: Baker Hughes Inc., erteilt am 10. September 2002
- Patent US4573533: Enhanced oil recovery. Angemeldet am 21. Juni 1984, veröffentlicht am 4. März 1986, Anmelder: American Cyanamid Company, Erfinder: Roderick G. Ryles, Albert G. Robustelli. und A. Sabhapondit et al., J. Appl. Polym. Sci., 87, (12), 1869–1878 (2003)
- Patent US20070204996: Fracturing a subterranean formation using an aqueous treatment fluid including a friction-reducing cationic polymer and an oxidizer as an anticoagulant (crosslinking, gelation inhibition) to prevent flocculation in the well bore. Angemeldet am 3. März 2006, veröffentlicht am 6. September 2007, Anmelder: Halliburton Energy Services, Erfinder: David McMechan et al.. und US 20100048430, Erfinder: G.P. Funkhouser, D. Loveless, Anmelder: Halliburton Energy Services, Inc., veröffentlicht am 25. Februar 2010
- valuepickr.com: Vinati-organics.

