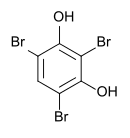
2,4,6-Tribromresorcin
2,4,6-Tribromresorcin ist eine chemische Verbindung, die zur Stoffgruppe der Phenole gehört.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4,6-Tribromresorcin | ||||||||||||||||||
| Andere Namen |
2,4,6-Tribrombenzen-1,3-diol | ||||||||||||||||||
| Summenformel | C6H3Br3O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 346,8 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
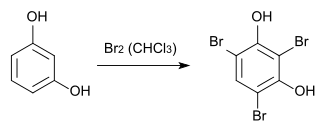
2,4,6-Tribromresorcin kann durch Bromierung von Resorcin in Chloroform hergestellt werden.[3][4]
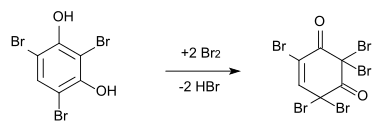
Wird Brom im Überschuss eingesetzt, reagiert das 2,4,6-Tribromresorcin zu 2,4,4,6,6-Pentabrom-1-cyclohexen-3,5-dion weiter.[5] Durch Zugabe von Kaliumiodid kann diese Reaktion rückgängig gemacht werden.
Reaktionen
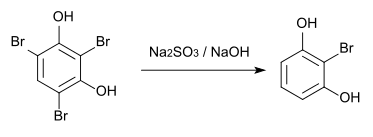
Aus 2,4,6-Tribromresorcin kann im Labor durch Umsetzung mit Natriumsulfit und Natriumhydroxid in einem 5:1 Wasser/Methanol-Gemisch 2-Bromresorcin hergestellt werden.[3]
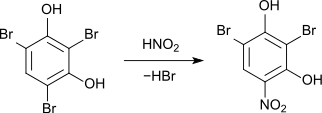
Die Nitrierung von 2,4,6-Tribromresorcin mit Salpetriger Säure führt zur Verdrängung eines Bromatoms unter Bildung von 2,6-Dibrom-4-Nitroresorcin.[6]
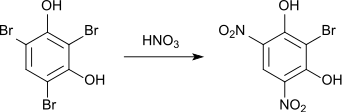
Wird die Nitrierung mit rauchender Salpetersäure durchgeführt, werden zwei Bromatome verdrängt, es entsteht 2-Brom-4,6-Dinitroresorcin.[7]
Wird das 2,4,6-Tribromresorcin vor der Nitrierung mit Acetanhydrid verestert, so lagert sich die Nitrogruppe an der Position 5 an.[7] Auch der Diethylether (Schmelzpunkt 68–69 °C) reagiert auf diese Weise.[7] Das Diacetat schmilzt bei 108 °C.[7]

Das Natriumsalz des 2,4,6-Tribromresorcins kann in ethanolischer Lösung hergestellt werden und kristallisiert mit zwei Molekülen Ethanol mit der stöchiometrischen Zusammensetzung C6HBr3(ONa)2·2C2H5OH.[7]
Einzelnachweise
- Datenblatt 2,4,6-Tribromoresorcinol bei Sigma-Aldrich, abgerufen am 17. März 2011 (PDF).
- J.E.Lightowler, H.J.Rylance: On the anti-inflammatory activity of some substituted phenolic compounds. In: British Journal of Pharmacology and Chemotherapy. 1964, Vol. 22, S. 221ff, PMID 1703990.
- Timo Liebig: Konkave N-Heterocyclische Katalysator-Systeme. Universität Kiel, 2006.
- Michael Abbass: Konkave 1,10-Phenantroline mit zusätzlicher Funktionalität in 4'-Position. Universität Kiel, 2002. urn:nbn:de:gbv:8-diss-17594
- H.P. Latscha, H.A. Klein, G.W. Linti: Analytische Chemie. 4. Auflage, Springer, 2003, ISBN 978-3-540-40291-6, S. 287 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. H. Hodgson, E. W. Smith: "The replacement of bromine in bromophenols by the nitro-group. Part I. 2:4:6-Tribromo-3-nitrophenol and -3-chlorophenol. Some cases of group migration" in J. Chem. Soc., 1931, 2268–2272. doi:10.1039/JR9310002268
- C. L. Jackson, F. L. Dunlap: Certain Bromine Derivatives of Resorcine. In: American Chemical Journal 1896, 18, S. 117ff. Volltext
