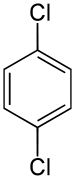
1,4-Dichlorbenzol
1,4-Dichlorbenzol, auch Paradichlorbenzol (PDCB, p-DCB) genannt, ist eine aromatische chemische Verbindung bestehend aus einem Benzolring mit zwei Chloratomen (–Cl) als Substituenten. Es entsteht als Nebenprodukt bei der Produktion von Monochlorbenzol und ist ein Feststoff mit starkem Geruch. Mit seinen beiden Konstitutionsisomeren 1,2-Dichlorbenzol und 1,3-Dichlorbenzol gehört es zur Stoffgruppe der Dichlorbenzole mit der Summenformel C6H4Cl2. Der Stoff befindet sich heute weltweit in der Luft und im Wasser und ist biologisch schwer abbaubar.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,4-Dichlorbenzol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H4Cl2 | |||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff mit kampferartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 147,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,248 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
174 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (49 mg/l bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 20 ml·m−3 bzw. 122 mg·m−3[3] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Wird Benzol direkt mit Chlor in Gegenwart einer Lewissäure wie z. B. Eisen(III)-chlorid oder Aluminiumchlorid umgesetzt, ergibt sich als Hauptprodukt Chlorbenzol in 80–90%iger Ausbeute. Die 1,2- und 1,4-Dichlorbenzole fallen bei dieser Reaktion nur in geringen Mengen als Nebenprodukte an.
Wird die Menge des eingesetzten Chlorierungsmittels deutlich erhöht, so können größere Mengen 1,4-Dichlorbenzol neben 1,2-Dichlorbenzol und wenig 1,3-Dichlorbenzol gewonnen werden. Weiterhin entstehen auch die höher chlorierten Benzole (z. B. Trichlorbenzole).
Eigenschaften
Physikalische Eigenschaften
1,4-Dichlorbenzol kristallisiert bei Raumtemperatur im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 1480 pm, b = 399 pm, c = 578 pm und β = 113°. In der Elementarzelle befinden sich zwei Formeleinheiten. Die Kristalle sind isomorph zu 1,4-Dibrombenzol.[5] Zwei weitere feste Phasen existieren, die Phasenübergänge finden bei 271,77 K und bei 304,35 K statt.[6]
Die Schmelzenthalpie von 1,4-Dichlorbenzol beträgt 17907 J·mol−1.[7] Die Koeffizienten der Antoine-Gleichung betragen für 1,4-Dichlorbenzol A = 4,12290, B = 1575,110 und C = −64,637.[8][9]
Chemische Eigenschaften
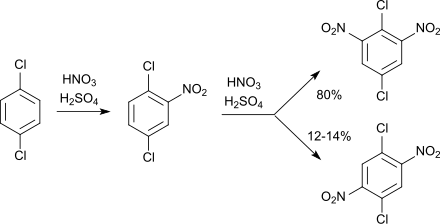
Die Nitrierung von 1,4-Dichlorbenzol mit Salpetersäure und Schwefelsäure führt zunächst zum 2-Nitro-1,4-dichlorbenzol, in weiterer Folge entsteht ein Gemisch von 2,6-Dinitro-1,4-dichlorbenzol und 2,5-Dinitro-1,4-dichlorbenzol im Verhältnis 7:1.[10][11]
Verwendung
Für das 1,4-Dichlorbenzol, das als Nebenprodukt anfällt, wurden in der Vergangenheit einige sehr umstrittene Einsatzgebiete gefunden. In vielen WC-Steinen wurde der Stoff mittlerweile durch alternative Stoffe wie Natriumdodecylbenzolsulfonat oder Natriumcarbonat ersetzt. In Steinen für Urinale in der Gastronomie wird er aber heute noch verwendet, da er stark, entfernt himbeerartig, riecht. Die Substanz hat jedoch keine keimtötende Wirkung. Daher wäre bei Urinalanlagen eine Geruchsneutralisation mit gewissen Cyclodextrinen oder Terpenen per Verdunster oder Zerstäuber eine biologisch vertretbare und effektivere Lösung als mit 1,4-Dichlorbenzol. Auch in Mottenkugeln (Globolkugeln) und Pestiziden sowie in der Sarghygiene findet 1,4-Dichlorbenzol noch Verwendung.[12]
1,4-Dichlorbenzol ist Ausgangsstoff zur Synthese von Polyphenylensulfid (PPS), ein hochtemperaturbeständiger thermoplastischer Kunststoff. Bei der Reaktion handelt es sich um die Polykondensation von 1,4-Dichlorbenzol mit Natriumsulfid, die in aprotischen Lösungsmitteln wie N-Methylpyrrolidon durchgeführt wird.[13]
.svg.png.webp)
1,4-Dichlorbenzol (Globol) wurde früher häufig (und zum Teil noch immer im kleinen Bereich) zur Desinfektion von Insektensammlungen verwendet.[14]
Gefahren
1,4-Dichlorbenzol ist ein in der Umwelt schlecht abbaubarer Stoff. Er ist sehr giftig für Wasserorganismen (WGK 2[1]) und kann daher längerfristig schädliche Wirkungen haben. Im tierischen Organismus wirkt es schädlich, indem es vorzugsweise Leber, Nieren und Lungen angreift. Es reizt auch Haut und Augen. In neueren Untersuchungen kam der Verdacht auf, dass 1,4-Dichlorbenzol krebserregend (karzinogen/kanzerogen) sein könnte.[12] 1,4-Dichlorbenzol depolarisiert die Nervenzellen und induziert so eine Übererregbarkeit, die mit der von Organochlorinsektiziden hervorgerufenen vergleichbar ist.[4]
Einzelnachweise
- Eintrag zu 1,4-Dichlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu 1,4-dichlorobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 106-46-7 bzw. 1,4-Dichlorbenzol), abgerufen am 2. November 2015.
- Erdölderivate – Wiederkäuer, abgerufen am 13. Juli 2011.
- U. Croatto, S. Bezzi, E. Bua: The Crystal Structure of p-Dichlorobenzene. In: Acta Cryst., 1952, 5, S. 825–829; doi:10.1107/S0365110X52002203.
- A. Dworkin, P. Figuière, M. Ghelfenstein, H. Szwarc: Heat capacities, enthalpies of transition, and thermodynamic properties of the three solid phases of p-dichlorobenzene from 20 to 330 K. In: The Journal of Chemical Thermodynamics, 1976, 8 (9), S. 835–844; doi:10.1016/0021-9614(76)90161-0.
- P. R. van der Linde, J. C. van Miltenburg, G. J. K. van den Berg, H. A. J. Oonk: Low-Temperature Heat Capacities and Derived Thermodynamic Functions of 1,4-Dichlorobenzene, 1,4-Dibromobenzene, 1,3,5-Trichlorobenzene, and 1,3,5-Tribromobenzene. In: J. Chem. Eng. Data, 2005, 50 (1), S. 164–172; doi:10.1021/je049762q.
- Eintrag zu 1,4-Dichlorbenzol. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 19. Juli 2011.
- P. N. Walsh, N. O. Smith: Sublimation Pressure of α-p-Dichloro-, β-p-Dichloro, p-Dibromo-, and p-Bromochlorobenzene. In: J. Chem. Eng. Data, 1961, 6 (1), S. 33–35; doi:10.1021/je60009a010.
- H. J. Page, B. R. Heasman: Nitration of p-Dichlorobenzene. In: J. Chem. Soc., Trans., 1923, 123, S. 3247–3255; doi:10.1039/CT9232303247.
- P. Hartley, J. B. Cohen: The Nitration Products of the Isomeric Dichlorobenzenes. In: J. Chem. Soc., Trans., 1904, 85, S. 865–870; doi:10.1039/CT9048500865; Volltext.
- Abwasserlexikon: Paradichlorbenzol
- Patent US3354129: Production of polymers from aromatic compounds. Veröffentlicht am 21. November 1967, Erfinder: J. T. Edmonds, H. W. Hill.
- Gerfried Deschka: Die Desinfektion kleiner Insektensammlungen nach neueren Gesichtspunkten, Steyrer Entomologenrunde 21, Steyr 1987; Inhaltsverzeichnis.


