1,3-Bis(diphenylphosphino)propan
1,3-Bis(diphenylphosphino)propan (abgekürzt: dppp) ist eine organische Verbindung. Sie wird als Ligand für katalytisch aktive Komplexe eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
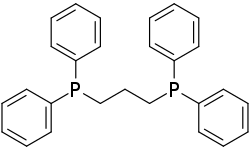 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Bis(diphenylphosphino)propan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C27H26P2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 412,46 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
dppp kann durch die Reaktion von Diphenylphosphan mit 1,3-Dibrompropan in Gegenwart einer Base hergestellt werden. Als Base kann hierzu Cäsiumhydroxid verwendet werden.[2] Die Base deprotoniert hierbei zunächst das Phosphin, welches dann nukleophil am Bromalkan angreift. Alternativ kann Triphenylphosphan mit Lithium in THF oder mit Natrium oder Kalium in Ammoniak zu den entsprechenden Phenylalkaliverbindungen und Alkalidiphenylphosphiden umgesetzt werden und nach selektiver Protonierung der Phenylalkaliverbindungen das verbleibende Alkalidiphenylphosphid mit 1,3-Dibrompropan umgesetzt werden.
Verwendung
Das Haupteinsatzgebiet von dppp ist die Verwendung als zweizähniger Chelatligand in übergangsmetallkatalysierten Kupplungsreaktionen.
Der Komplex mit Nickelchlorid ([Ni(dppp)Cl2]) kann als Katalysator für die Alkylierung von Enolethern mit Grignard-Reagenzien verwendet werden.[3]
Einzelnachweise
- Datenblatt 1,3-Bis(diphenylphosphino)-propan (PDF) bei Merck, abgerufen am 17. März 2011.
- M. T. Honaker, B. J. Sandefur, J. L. Hargett, A. L. McDaniel, R. N. Salvatore in: Tetrahedron Lett. 2003, 44, 46, 8373–8378.
- E. Wenkert in: J. Org. Chem. 1984, 49, 4894.
