β-Methylamino-L-alanin
β-Methylamino-L-alanin, oder BMAA, ist eine nichtproteinogene Aminosäure, die von Cyanobakterien produziert wird. BMAA ist ein Neurotoxin, dessen potentielle Beteiligung an verschiedenen neurodegenerativen Erkrankungen Gegenstand wissenschaftlicher Forschung ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
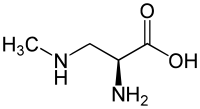 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | β-Methylamino-L-alanin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H10N2O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 118,14 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Struktur und Eigenschaften
BMAA ist ein Derivat der Aminosäure Alanin und besitzt zusätzlich eine Methylamino-Gruppe in der Seitenkette. Die nichtproteinogene Aminosäure ist in wässriger Lösung basisch. Der isoelektrische Punkt liegt bei einem pH-Wert von 8,09. Die beiden pKS-Werte der Aminogruppen liegen bei 6,63 (pKα) und 9,76 (pKβ).[2]
Vorkommen und Nachweis
BMAA wird in Salzwasser, Süßwasser, aber auch an Land von Cyanobakterien produziert.[3][4] Kultivierte, nicht stickstoffbindende Cyanobakterien zeigen in stickstoffarmen Medien eine erhöhte BMAA-Produktion.[5] BMAA wurde in Wasserorganismen und Pflanzen gefunden, die Symbiosen mit Cyanobakterien eingehen, dazu gehören bestimmte Flechten, Algenfarne, die Blattstiele der tropischen Blütenpflanze Gunnera, Palmfarne sowie Tiere, die die Hüllen der Palmfarnsamen aufnehmen, wie die eigentlichen Flughunde.[6][7][8][9]
Haifischflossen enthalten hohe Konzentrationen an BMAA.[10] Aufgrund der Neurotoxizität von BMAA stellt der Konsum von Haifischflossensuppe und Haifischknorpeltabletten ein potentielles Gesundheitsrisiko dar.[11] Der Nachweis von BMAA ist mit verschiedenen Labormethoden möglich, darunter Flüssigchromatographie, High-performance Flüssigchromatographie, Massenspektrometrie, Proteinsequenzierung, Kapillarelektrophorese und NMR-Spektroskopie.[12]
Neurotoxizität
BMAA kann die Blut-Hirn-Schranke von Ratten durchqueren. Dies verläuft langsamer als die Aufnahme in andere Organe, allerdings bildet sich dadurch ein Reservoir, das über einen langen Zeitraum BMAA freigibt.[13][14]
Mechanismen
Der Mechanismus, durch den BMAA-Aufnahme über die Schädigung von Motoneuronen zum Tod führen kann, ist nicht vollständig erforscht, aber vieles deutet auf mehrere Wirkmechanismen hin.
Die akute Wirkung von BMAA ist excitotoxisch an Glutamatrezeptoren wie NMDA-, AMPA- und Kainat-Rezeptoren.[15][16] Aktivierung des metabotropen Glutamatrezeptor 5 löst im betroffenen Neuron vermutlich oxidativen Stress durch Abbau von Glutathion aus.[17]
BMAA kann an Stelle von L-Serin fälschlicherweise in entstehende Proteine eingebaut werden, was zu fehlerhafter Proteinfaltung und Proteinaggregation führen kann. Dies sind typische Kennzeichen von Proteinfehlfaltungserkrankungen bzw. Tauopathien wie z. B. Alzheimer-, Parkinson-Krankheit, amyotropher Lateralsklerose (ALS), progressiver supranukleärer Blickparese (PSP), und Lewy-Körper-Demenz. In-vitro-Studien haben gezeigt, dass ein Überschuss an vorhandenem L-Serin den Einbau von BMAA in Proteine unterbinden kann.[18]
Wirkung
Eine Studie, die mit südlichen Grünmeerkatzen, welche bezüglich des apoE4-Gens homozygot sind (einem Risikofaktoren für die Alzheimer-Krankheit), fand bei Tieren, denen BMAA oral verabreicht wurde, typische histopathologische Kennzeichen für Morbus Alzheimer, darunter Beta-Amyloid-Plaque und Akkumulation neurofibrillärer Tangles (Alzheimer-Fibrillen). Versuchstiere, die geringere BMAA-Dosen verabreicht bekamen, zeigten eine mit der BMAA-Menge korrelierte Verringerung der pathologischen Merkmale. Versuchstiere, die gleichzeitig L-Serin verabreicht bekamen, hatten 70 % weniger Beta-Amyloid-Plaques und neurofibrilläre Tangles als Tiere, denen nur BMAA verabreicht worden war. Die Ergebnisse deuten darauf hin, dass L-Serin die neurotoxischen Effekte von BMAA verringern kann.
In diesem Experiment wurden erstmals in vivo Alzheimer-Erkrankungen induziert, die sowohl Amyloid-Beta-Plaques als auch hyperphosphoryliertes Tau-Protein zeigen. Die Studie zeigt außerdem, dass das natürliche Toxin BMAA in Interaktion mit der genetischen Prävalenz neurodegenerative Erkrankungen auslösen kann.[19]
Degenerative Erkrankungen des Bewegungsapparats wurden in Tieren beschrieben, die sich von Palmfarnspezies ernähren. Diese Beobachtung ist Ausgangspunkt von Studien zu Zusammenhängen zwischen Palmfarnen und der Ätiologie des Komplexes der Erkrankungen Amyotrophe Lateralsklerose, Parkinson, Demenz (ALS/PDC). Im Rahmen dieser Studien wurde BMAA nachgewiesen. In Rhesusmakaken wirkt BMAA stark neurotoxisch.[20] Zu den Symptomen gehören:
- Muskelatrophie
- Degenerierung von Zellen im Vorderhorn des Rückenmarks
- Degenerierung und teilweiser Verlust von Pyramidenzellen im Motorcortex
- Verhaltensstörungen
- Übertragungsprobleme im zentralen Bewegungsapparat.
- Neuropathologische Veränderungen von Betz-Zellen im Motorcortex
Gemäß einer Studie können kultivierte Motoneuronen aus dem Rückenmark von Mäusen durch geringe Konzentrationen von BMAA selektiv abgetötet werden.[16][21]
Weitere Studien zeigen, dass neugeborene Ratten, die mit BMAA behandelt wurden, progressive Neurodegeneration im Hippocampus aufweisen, inklusive intrazellulärer fibrillärer Einschlüsse und eingeschränkter Lernfähigkeit im Erwachsenenalter.[22][23][24] Außerdem wurde nachgewiesen, dass BMAA in Nagetieren über die Muttermilch von der Mutter auf den Nachwuchs übertragen werden kann, sodass eine Exposition von Menschen über Kuh- oder Muttermilch möglich erscheint.[25]
Wirkung im Menschen
Ernährungsbedingte chronische BMAA-Exposition wird als eine wesentliche Ursache angesehen für Erkrankungen des Komplexes Amyotrophe Lateralsklerose, Parkinson, Demenz (ALS/PDC), welche eine extrem hohe Prävalenz in der Bevölkerungsgruppe der Chamorro auf der Insel Guam haben.[26] Die Chamorro nennen das Krankheitsbild lytico-bodig.[27] In den 1950er Jahren waren die Prävalenz und Todesfallraten mit ALS/PDC unter den Chamorro auf den Inseln Guam und Rota 50- bis 100-mal so hoch wie in entwickelten Ländern.[27] Für das Krankheitsbild wurden keine erblichen oder viralen Faktoren gefunden. Da die Fallzahlen auf Guam nach 1963 kontinuierlich sanken, begann die Suche nach möglichen Umweltfaktoren.[28] Die Verwendung von Mehl aus Samen von Palmfarnen (Cycas micronesica[29]) in der traditionellen Küche nahm ab, da die Pflanzen seltener wurden und die Chamorro nach dem Zweiten Weltkrieg die amerikanische Kultur adaptierten.[30] Palmfarne gehen Symbiosen mit Cyanobakterien der Gattung Nostoc ein. Diese BMAA produzierenden Bakterien leben in spezialisierten Wurzeln, die durch die gefallenen Blätter ins Licht wachsen.[31]
Abgesehen von der direkten Aufnahme über Nahrungsmittel, die Palmfarnmehl enthalten, kann BMAA auch durch Biomagnifikation aufgenommen werden. Eigentliche Flughunde gelten bei den Chamorro als Delikatesse; die Tiere ernähren sich von den fleischigen Samenschalen der Palmfarne und reichern das Toxin in ihrem Körper an. 24 Flughundspezies aus Museumssammlungen wurden auf BMAA getestet. In Tieren aus Guam wurden hohe Konzentrationen an BMAA gefunden.[32] Weitergehende Forschung untersucht Biomagnifikation von BMAA außerhalb von Guam.
Studien an menschlichem Hirngewebe von ALS/PDC-, ALS-, Alzheimer-, Parkinson- und Chorea-Huntington-Erkrankten sowie gesunden Kontrollgruppen deuten darauf hin, dass BMAA in nicht-genetisch bedingten progressiven neurodegenerativen Erkrankungen vorliegen kann, nicht aber in Kontrollgruppen und genetisch bedingten Chorea-Huntington-Erkrankten.[33][34][35][36]
Weitere Studien beschäftigen sich mit der Rolle von BMAA als Umweltfaktor bei neurodegenerativen Erkrankungen.[37][38]
Klinische Studien
Im Rahmen klinischer Studien wurden sichere und effektive Wege untersucht, ALS-Patienten mit L-Serin[39] oder Zink und Kupfer (Optizinc) zu behandeln.[40]
Weiterführende Links
- Oxalyldiaminopropionsäure, ein verwandtes Toxin
Literatur
- Nordic Council of Ministers (Hrsg.): Analysis, occurrence, and toxicity of β-methylaminoalanine (BMAA). Nordic Council of Ministers, 2007, ISBN 92-893-1541-5 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. Diaz-Parga, J. J. Goto, V. V. Krishnan: Chemistry and Chemical Equilibrium Dynamics of BMAA and Its Carbamate Adducts. In: Neurotoxicity research. Band 33, Nummer 1, Januar 2018, S. 76–86, doi:10.1007/s12640-017-9801-2, PMID 28921378, PMC 5834315 (freier Volltext).
- Cox, PA, Banack, SA, Murch, SJ, Rasmussen, U, Tien, G, Bidigare, RR, Metcalf, JS, Morrison, LF, Codd, GA, Bergman, B.: Diverse taxa of cyanobacteria produce b-N-methylamino-L-alanine, a neurotoxic amino acid. In: PNAS. 102, Nr. 14, 2005, S. 5074–5078. bibcode:2005PNAS..102.5074C. doi:10.1073/pnas.0501526102. PMID 15809446. PMC 555964 (freier Volltext).
- Esterhuizen, M, Downing, TG.: β-N-methylamino-L-alanine (BMAA) in novel South African cyanobacterial isolates. In: Ecotoxicology and Environmental Safety. 71, Nr. 2, 2008, S. 309–313. doi:10.1016/j.ecoenv.2008.04.010. PMID 18538391.
- Downing, S, Banack, SA, Metcalf, JS, Cox, PA, Downing, TG.: Nitrogen starvation of cyanobacteria results in the production of β-N-methylamino-L-alanine. In: Toxicon. 58, Nr. 2, 2011, S. 187–194. doi:10.1016/j.toxicon.2011.05.017. PMID 21704054.
- Vega, A, Bell, A.: a-amino-β-methylaminopropionic acid, a new amino acid from seeds of cycas circinalis. In: Phytochemistry. 6, Nr. 5, 1967, S. 759–762. doi:10.1016/s0031-9422(00)86018-5.
- Banack, SA, Cox, PA.: Biomagnification of cycad neurotoxins in flying foxes: implications for ALS-PDC in Guam. In: Neurology. 61, Nr. 3, 2003, S. 387–9. doi:10.1212/01.wnl.0000078320.18564.9f. PMID 12913204.
- Masseret, E, Banack, S, Boumédiène, F, Abadie, E, Brient, L, Pernet, F, Juntas-Morales, R, Pageot, N, Metcalf, J, Cox, P, Camu, W.: Dietary BMAA exposure in an amyotrophic lateral sclerosis cluster from Southern France. In: PLOS ONE. 8, Nr. 12, 2013, S. e83406. bibcode:2013PLoSO...883406M. doi:10.1371/journal.pone.0083406. PMID 24349504. PMC 3862759 (freier Volltext).
- Field, NC, Metcalf, JS, Caller, TA, Banack, SA, Cox, PA, Stommel, EW.: Linking β-methylamino-L-alanine exposure to sporadic amyotrophic lateral sclerosis in Annapolis, MD. In: Toxicon. 70, 2013, S. 179–183. doi:10.1016/j.toxicon.2013.04.010. PMID 23660330.
- Kiyo Mondo, Neil Hammerschlag, Margaret Basile, John Pablo, Sandra A. Banack, Deborah C. Mash: Cyanobacterial Neurotoxin β-N-Methylamino-L-alanine (BMAA) in Shark Fins. In: Marine Drugs. 10, Nr. 2, 2012, S. 509–520. doi:10.3390/md10020509. PMID 22412816. PMC 3297012 (freier Volltext).
- Neurotoxins in shark fins: A human health concern. Science Daily. 23. Februar 2012.
- Cohen, SA.: Analytical techniques for the detection of a-amino- β-methylaminopropionic acid. In: Analyst. 137, Nr. 9, 2012, S. 1991–2005. doi:10.1039/c2an16250d. PMID 22421821.
- Mash D, et al. (Seite nicht mehr abrufbar, Suche in Webarchiven: Neurotoxic non-protein amino acid BMAA in brain from patients dying with ALS and Alzheimer’s disease) poster presented at: American Academy of Neurology Annual Meeting, Chicago, IL, 17 April 2008 Neurology 2008;70(suppl 1):A329.
- Xie X, et al. (Seite nicht mehr abrufbar, Suche in Webarchiven: Tracking brain uptake and protein incorporation of cyanobacterial toxin BMAA) abstract presented at: 22nd Annual Symposium on ALS/MND, Sydney, Australia, 1 December 2011.
- Weiss, JH, Koh, J, Choi. D.: Neurotoxicity of β -N-methylamino-L-alanine (BMAA) and β-N-oxalylamino-L-alanine (BOAA) on cultured cortical neurons. In: Brain Research. 497, Nr. 1, 1989, S. 64–71. doi:10.1016/0006-8993(89)90970-0. PMID 2551452.
- Lobner, D, Piana, PM, Salous, AK, Peoples, RW.: β-N-methylamino-L-alanine enhances neurotoxicity through multiple mechanisms. In: Neurobiology of Disease. 25, Nr. 2, 2007, S. 360–366. doi:10.1016/j.nbd.2006.10.002. PMID 17098435. PMC 3959771 (freier Volltext).
- Rush, T, Liu, X, Lobner, D.: Synergistic toxicity of the environmental neurotoxins methylmercury and β-N-methylamino-L-alanine. In: Neuropharmacology and Neurotoxicology. 23, Nr. 4, 2012, S. 216–219. doi:10.1097/WNR.0b013e32834fe6d6. PMID 22314682.
- Dunlop, R.A., Cox, P.A., Banack, S.A., Rodgers, J.K.: The Non-Protein Amino Acid BMAA Is Misincorporated into Human Proteins in Place of l-Serine Causing Protein Misfolding and Aggregation. In: PLOS ONE. 8, Nr. 9, 2013, S. e75376. bibcode:2013PLoSO...875376D. doi:10.1371/journal.pone.0075376. PMID 24086518. PMC 3783393 (freier Volltext).
- Cox, PA, Davis, DA, Mash, DC, Metcalf, JS, Banack, SA.: Dietary exposure to an environmental toxin triggers neurofibrillary tangles and amyloid deposits in the brain. In: Proceedings of the Royal Society B. 283, Nr. 1823, 2015, S. 20152397. doi:10.1098/rspb.2015.2397. PMID 26791617. PMC 4795023 (freier Volltext).
- Spencer, PS, Hugon, J, Ludolph, A, Nunn, PB, Ross, SM, Roy, DN, Schaumburg, HH.: Discovery and partial characterization of primate motor-system toxins. In: Ciba Foundation Symposium. Novartis Foundation Symposia, Nr. 126, 1987, S. 221–38. doi:10.1002/9780470513422.ch14. PMID 3107939.
- Rao, SD, Banack, SA, Cox, PA, Weiss, JH.: BMAA selectively injures motor neurons via AMPA/kainate receptor activations. In: Experimental Neurology. 201, Nr. 1, 2006, S. 244–52. doi:10.1016/j.expneurol.2006.04.017. PMID 16764863.
- Oskar Karlsson, Anna-Lena Berg, Jörg Hanrieder, Gunnel Arnerup, Anna-Karin Lindström, Eva B. Brittebo: Intracellular fibril formation, calcification, and enrichment of chaperones, cytoskeletal, and intermediate filament proteins in the adult hippocampus CA1 following neonatal exposure to the nonprotein amino acid BMAA. In: Archives of Toxicology. 89, Nr. 3, 2014, ISSN 0340-5761, S. 423–436. doi:10.1007/s00204-014-1262-2. PMID 24798087. PMC 4335130 (freier Volltext).
- O. Karlsson, E. Roman, E. B. Brittebo: Long-term Cognitive Impairments in Adult Rats Treated Neonatally with -N-Methylamino-L-Alanine. In: Toxicological Sciences. 112, Nr. 1, 2009, ISSN 1096-6080, S. 185–195. doi:10.1093/toxsci/kfp196. PMID 19692667.
- Karlsson, O. (2011). Distribution and Long-term Effects of the Environmental Neurotoxin β-N-methylamino-L-alanine (BMAA): Brain changes and behavioral impairments following developmental exposure. urn:nbn:se:uu:diva-140785.
- Marie Andersson, Oskar Karlsson, Ulrika Bergström, Eva B. Brittebo, Ingvar Brandt: Maternal Transfer of the Cyanobacterial Neurotoxin β-N-Methylamino-L-Alanine (BMAA) via Milk to Suckling Offspring. In: PLOS ONE. 8, Nr. 10, 2013, ISSN 1932-6203, S. e78133. doi:10.1371/journal.pone.0078133. PMID 24194910. PMC 3806833 (freier Volltext).
- Cox, PA, Sacks, OW.: Cycad neurotoxins, consumption of flying foxes, and ALS-PDC disease in Guam. In: Neurology. 58, Nr. 6, 2002, S. 956–9. doi:10.1212/wnl.58.6.956. PMID 11914415.
- Kurland, LK, Mulder, DW.: Epidemiologic investigations of amyotrophic lateral sclerosis. In: Neurology. 4, Nr. 5, 1954, S. 355–78. doi:10.1212/wnl.4.5.355. PMID 13185376.
- Galasko, D, Salmon, DP, Craig, UK, Thal, LJ, Schellenberg, G, Wiederholt, W.: Clinical features and changing patterns of neurodegenerative disorders on Guam, 1997–2000. In: Neurology. 58, Nr. 1, 2002, S. 90–7. doi:10.1212/wnl.58.1.90. PMID 11781411.
- Hill, KD.: The cycas rumphii complex (Cycadeceae) in New Guinea and the Western Pacific. In: Australian Systematic Botany. 7, Nr. 6, 1994, S. 543–567. doi:10.1071/sb9940543.
- Whiting, MG.: Toxicity of cycads. In: Economic Botany. 17, Nr. 4, 1963, S. 270–302. doi:10.1007/bf02860136.
- Rai, A.N.; Soderback, E.; Bergman, B.: Tansley Review No. 116. Cyanobacterium-Plant Symbioses. In: The New Phytologist. 147, Nr. 3, 2000, S. 449–481. doi:10.1046/j.1469-8137.2000.00720.x.
- Banack, SA, Murch, SJ, Cox, PA.: Neurotoxic flying foxes as dietary items for the Chamorro people, Mariana Islands. In: Ethnopharmacology. 106, Nr. 1, 2006, S. 97–104. doi:10.1016/j.jep.2005.12.032. PMID 16457975.
- Murch, SJ, Cox, PA, Banack, SA.: A mechanism for slow release of biomagnified cyanobacterial neurotoxins and neurodegenerative disease in Guam. In: PNAS. 101, Nr. 33, 2004, S. 12228–12231. bibcode:2004PNAS..10112228M. doi:10.1073/pnas.0404926101. PMID 15295100. PMC 514403 (freier Volltext).
- Murch, SJ, Cox, PA, Banack, SA, Steele, JC, Sacks, OW.: Occurrence of b-methylamino-L-alanine (BMAA) in ALS/PDC patients from Guam. In: Acta Neurologica Scandinavica. 110, Nr. 4, 2004, S. 267–9. doi:10.1111/j.1600-0404.2004.00320.x. PMID 15355492.
- Pablo, J, Banack, SA, Cox, PA, Johnson, TE, Papapetropoulos, Bradley, WG, Buck, A, Mash, DC.: Cyanobacterial neurotoxin BMAA in ALS and Alzheimer's disease. In: Acta Neurologica Scandinavica. 120, Nr. 4, 2009, S. 215–225. doi:10.1111/j.1600-0404.2008.01150.x. PMID 19254284.
- Bradley, WG, Mash, DC.: Beyond Guam: the cyanobacterial/BMAA hypothesis of the cause of ALS and other neurodegenerative diseases. In: ALS. 10, 2009, S. 7–20. doi:10.3109/17482960903286009. PMID 19929726.
- Banack, SA, Caller, TA, Stommel, EW.: The cyanobacteria derived toxin beta-n-methylamino-L-alanine and Amyotrophic Lateral Sclerosis. In: Toxins. 2, Nr. 12, 2010, S. 2837–2850. doi:10.3390/toxins2122837. PMID 22069578. PMC 3153186 (freier Volltext).
- Holtcamp, W.: The emerging science of BMAA: do cyanobacteria contribute to neurodegenerative disease?. In: Environmental Health Perspectives. 120, Nr. 3, 2012, S. a110–a116. doi:10.1289/ehp.120-a110. PMID 22382274. PMC 3295368 (freier Volltext).
- Klinische Studie (Phase 2): Determining the Safety of L-serine in ALS bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase 2): Safety Study of High Doses of Zinc in ALS Patients bei Clinicaltrials.gov der NIH