Motorcortex
Der Moto(r)cortex (von lateinisch motor „Beweger“; von lateinisch cortex „Rinde“), auch motorische bzw. somatomotorische Rinde, ist ein histologisch abgrenzbarer Bereich der Großhirnrinde (Neocortex) und das funktionelle System, von dem aus willkürliche Bewegungen gesteuert und aus einfachen Bewegungsmustern komplexe Abfolgen zusammengestellt werden. Er bildet die übergeordnete Steuereinheit des Pyramidalen Systems und liegt in den hinteren (posterioren) Zonen des Frontallappens.
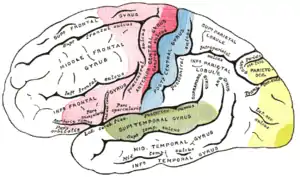
Reflexhafte Bewegungen (Muskeleigenreflexe und Fremdreflexe) entstehen hingegen auf niederem Niveau (im Rückenmark oder im Hirnstamm) und sind daher auch nicht willentlich beeinflussbar. Andere funktionelle Systeme wirken an Bewegungsleistungen mit: Für die Steuerung des Muskeltonus sind die Basalganglien wichtig. Zur räumlichen Bemessung, Abschätzung der nötigen Kraft und Schnelligkeit und Glättung der Bewegungen ist die Mitarbeit des Kleinhirns notwendig. Diese sind wie die Olive und der Nucleus ruber Elemente des extrapyramidalmotorischen Systems. Diese kategorische Einteilung (pyramidal-extrapyramidal) ist aber inzwischen verlassen worden, da sich die kortikalen und subkortikalen Systeme weitgehend überschneiden, und auch nicht-motorische Hirnareale, wie beispielsweise der hintere (posteriore) Parietalcortex, eine entscheidende Rolle für die Planung und Ausführung einfacher und komplexer motorischer Handlungen (z. B. zielgerichtetes Greifen von Objekten) besitzt.
Definition und anatomische Eingrenzung
Früher wurde die Gesamtheit des erregbaren Cortex als motorischer Cortex angesehen. Darunter verstand man die Summe der Großhirngebiete, bei deren äußerer elektrischer Stimulation sichtbare Bewegungen hervorgerufen werden können. Da dies bei ausreichend hohen Reizspannungen auch an praktisch allen assoziativen und einigen sensiblen Arealen möglich ist, tendiert man heute dazu, unter Motorcortex nur die vor der Zentralfurche (Sulcus centralis) gelegenen Areale, die einen typischen cytoarchitektonischen Aufbau besitzen, zu fassen.
Dazu gehören der Gyrus praecentralis und die hinteren (posterioren) Anteile der Gyri frontalis superior, frontalis medius und frontalis inferior sowie der vordere (anteriore) Abschnitt des Lobulus paracentralis.
Histologie
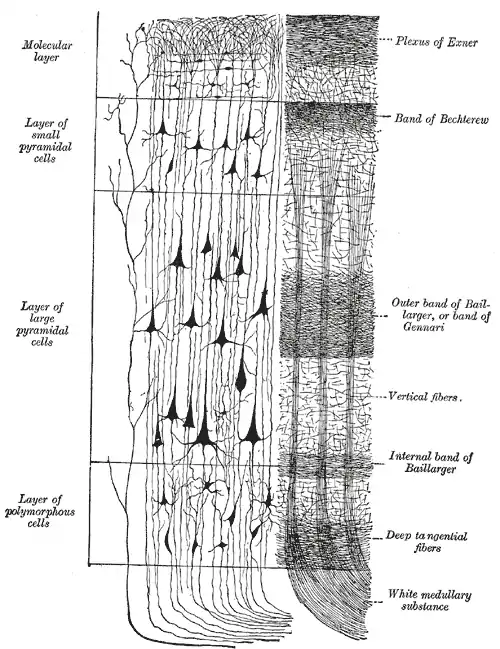
links: Golgi-Imprägnation (Zellen)
rechts: Weigertfärbung (Fasern)
Histologisch gehört der Motorcortex zum Isocortex. Das bedeutet, dass er einen definierten sechsschichtigen Grundaufbau hat, den er mit allen phylogenetisch jungen Arealen der Großhirnrinde teilt. Die innere Körnerzellschicht, die in sensorischen Arealen sehr ausgeprägt ist und auch in präfrontalen Regionen vorkommt, fehlt hier beziehungsweise ist nicht von der äußeren Pyramidenzellschicht abgrenzbar. Man spricht deshalb auch von agranulärem Cortex. Aufgrund der nur hier vorkommenden Riesenneurone in der 5. Schicht (Betz-Riesenzellen) wird die primär-motorische Rinde auch als Area gigantocellularis bezeichnet. Die frontal angrenzenden Felder sind ähnlich aufgebaut, besitzen allerdings keine Rieseneurone, sie werden deshalb auch als Area paragigantocellularis zusammengefasst. Die primärmotorische Rinde erreicht in einigen Gebieten (Lobulus paracentralis) mit 3 bis 5 mm die größte Breite des Cortex überhaupt.
Die Schichten heißen im Einzelnen:
- I. Lamina molecularis (Molekularschicht)
- II. Lamina granularis externa (äußere Körnerzellschicht)
- III. Lamina pyramidalis externa (äußere Pyramidenzellschicht)
- (IV. Lamina granularis interna; innere Körnerzellschicht)
- Diese Schicht ist im Motorcortex histologisch nicht sichtbar. Im Grunde ist es eine reine Definitionsfrage, ob man ihre Existenz dort ablehnt[1] oder sie als mit der III. Schicht verschmolzen ansieht.[2]
- V. Lamina pyramidalis interna oder Lamina ganglionaris (innere Pyramidenzellschicht)
- Hier liegen die Pyramidenzellen, die die Bewegungsanweisungen schließlich durch ihre Zellfortsätze (Axone) an periphere Motoneurone weiterleiten. Darunter sind in der primär-motorischen Rinde auch die sogenannten Betz-Riesenzellen, die zu den größten Zellen im menschlichen Organismus gehören. Sie sind allerdings deutlich in der Unterzahl.
- VI. Lamina multiformis (vielformige Schicht)
Funktionelle und histologische Einteilung
Funktionell wird die primär-motorische Rinde (in angelsächsischer Literatur: M1) von der supplementär-motorischen Rinde (supplementary motor area, SMA) und der prämotorischen Rinde (premotor area, PMA oder auch nur PM) unterschieden. Letztere dienen nach heutigem Verständnis dem Erstellen bestimmter Bewegungsabfolgen aus einem erlernten Fundus von Bewegungen und der Vorbereitung willkürlicher (sowohl bewusster als auch unbewusster) Bewegungen. Die in der primär-motorischen Rinde liegenden Motoneurone sind der hauptsächliche gemeinsame Ausgang des Motorcortex, da vor allem ihre Axone das Rückenmark und die motorischen Hirnnervenkerne erreichen. Nach dortiger Umschaltung auf das periphere Motoneuron (Vorderhornzelle) gelangen die Befehle schließlich zur Willkür-Muskulatur.
Nach dem histologischen Hirnatlas von Korbinian Brodmann (siehe Brodmann-Areal) entspricht das Areal 4 der primär-motorischen Rinde; die supplementär-motorische Rinde und die prämotorische Rinde werden vom Areal 6 gebildet. Moderne Unterteilungen, die sich mehr an der Funktion orientieren, unterscheiden insgesamt sieben bis neun Felder, wobei diese Unterteilungen nur auf Grund von Untersuchungen an nicht-humanen Primaten, wie z. B. Rhesus-Affen, erfolgt sind (z. B. nach G. Rizzolatti F1 [=M1] bis F7).
Primär-motorische Rinde (M1)

Die primär-motorische Rinde liegt zum überwiegenden Teil auf der Rindenwölbung vor der Zentralfurche (Gyrus praecentralis). Bemerkenswert ist die sogenannte Somatotopie, das heißt, dass benachbarte Regionen des Körpers auch in ihren Repräsentationen auf der primär-motorischen Rinde nebeneinander liegen. Der Körper ist somit verkleinert und kopfstehend als „Homunculus“ auf der Hirnrinde abgebildet. Allerdings sind die Proportionen des Homunculus verzerrt, da bestimmte Körperbereiche eine sehr fein abgestimmte Motorik besitzen, dies gilt beim Menschen vor allem für die Hand und die Sprechmuskulatur. Andere Regionen können hingegen nur vergleichsweise grob bewegt werden (Rücken) oder haben einen höheren Anteil automatischer Regulation (Halte- und Stützmuskulatur). Die jeweiligen Rindenareale sind entsprechend größer oder kleiner. Die Somatotopie in M1 ist jedoch immer noch deutlich gröber ausgeprägt als die der primären sensorischen Hirnrinde (S1, Area 3b), welche eine punktgenaue Repräsentation der Körperoberfläche besitzt.
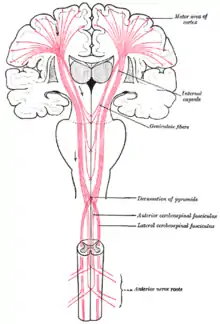
Die absteigenden (efferenten) Bahnen, die die Hirnrinde verlassen, bilden zusammen den Tractus corticonuclearis, der die motorischen Hirnnervenkerne versorgt, und den Tractus corticospinalis, also die Pyramidenbahn.
Prämotorische Rinde (PMA/PM/PMC)
Dieses recht ausgedehnte Rindengebiet (Brodmann Areae 6 und 8, = Areae extrapyramidales) liegt vor der primär-motorischen Rinde und befindet sich etwas seitlicher (lateral) auf der Konvexität der Hirnoberfläche, während die supplementär-motorische Rinde zur Kopfmitte zu (medial) und überwiegend jenseits der Mantelkante, sozusagen auf den sich gegenüberliegenden Flächen der Hirnhemisphären lokalisiert ist. Die Aufgabe dieses Feldes ist es, Bewegungsentwürfe zu erstellen und mit dem Kleinhirn und den Basalganglien abzustimmen. Dabei fließen auch sensorische Informationen, die beispielsweise das notwendige Ausmaß einer Bewegung definieren, ein. Eine wichtige Unterteilung des Prämotorcortex ist die in den dorsalen Prämotorcortex (dPMC oder PMd) und in den etwas tiefer zur Sylvischen Fissur hin gelegenen ventralen Prämotorcortex (vPMC oder PMv). Beide Cortices sind insbesondere in die Transformation von visuellen Informationen (zum Beispiel Position und Form eines Gegenstandes) in motorische Programme involviert. Dabei kodieren Neurone des dPMC bevorzugt für die Position eines Objektes im Raum, wohingegen der vPMC die Hand- und Fingeröffnung zum Greifen eines Objektes steuert. Beide Areale besitzen intensive Verbindungen zum Parietalcortex, wobei dPMC eher vom Lobulus parietalis superior (SPL) und vPMC vom Lobulus parietalis inferior (IPL) und insbesondere vom Sulcus intraparietalis (IPS) Projektionen erhält. Die parietalen Areale sind dagegen stark mit den visuellen Rindenarealen verbunden. Auf Grund dieser anatomischen Begebenheiten hat Rizzolatti eine Theorie zur kortikalen Kontrolle von Greifbewegungen konzipiert, nämlich dass visuelle Information aus dem primären visuellen Cortex (V1) über höhere visuelle Areale (V2-V8) zum Parietalcortex gelangt, in welchem die Information auf Lokalisation und Form analysiert wird, welches an die entsprechenden prämotorischen Areale weitergeleitet wird, die letztendlich den primär-motorischen Cortex ansteuern. Die Prüfung dieses Konzepts ist Gegenstand der aktuellen Hirnforschung.[3]
Einige Nervenzellen im prämotorischen Areal sind sowohl bei der Planung und Ausführung als auch bei der passiven Beobachtung derselben Bewegung bei einem anderen Individuum aktiv (sogenannte Spiegelneurone).[4][5] Man vermutet ihre Bedeutung in imitativen Lernprozessen (siehe auch: Lernen am Modell). Neuere Hypothesen gehen aber eher davon aus, dass die Spiegelneurone (die auch in anderen Hirnarealen wie zum Beispiel dem Lobulus parietalis inferior zu finden sind) eher das „Verständnis“ einer Aktion kodieren: Bei Makaken feuern einige Spiegelneurone nur, wenn der Affe nach einem Apfel greift, nicht aber wenn die Bewegung ohne Apfel ausgeführt wird. Man vermutet, dass Störungen dieses „Verständnisnetzwerkes“ eine pathophysiologische Grundlage für Autismus sein könnte.
Auch das für die Sprachproduktion wichtige Broca-Areal (motorisches Sprachzentrum, Areal 44 und Areal 45) und das sogenannte frontale Augenfeld (Areal 8) gehören funktionell zum PMA, obwohl sie strukturell eher ein „präfrontales“ Muster besitzen (granulärer Cortex). Hier zeigt sich jedoch die ausgesprochene funktionelle Heterogenität des Prämotorcortex.
Supplementär-motorische Rinde (SMA)
Die supplementär-motorische Rinde spielt eine Rolle beim Erlernen von Handlungsabfolgen[6] und bei der Vorbereitung komplexer Bewegungsmuster.[7] Versuche an Affen zeigten, dass die vorübergehende Blockade der SMA zur Unfähigkeit führt, Bewegungen zu initiieren.[8] Hinweis auf die vorbereitende und bewegungseinleitende Funktion der supplementär-motorischen Rinde ist auch eine gesteigerte elektrophysiologische Aktivität, die sich dort bereits mehr als eine Sekunde vor dem sichtbaren Einsetzen einer Bewegung nachweisen lässt: das sogenannte Bereitschaftspotential[9] (Siehe auch: Libet-Experiment). Die SMA besitzt auch eine wichtige Funktion zur Kontrolle von bimanuellen, d. h. beidhändigen Bewegungen: Professor Tanji beschrieb in den 80er Jahren bei Makaken erstmals das Vorkommen von Neuronen, die sowohl bei einhändigen wie auch beidhändigen Handbewegungen feuerten. Die exklusive Rolle der SMA für bimanuelle Aktionen ist aber mittlerweile revidiert worden, da auch anderen Regionen – wie z. B. M1 – bimanuelle Neurone besitzen. Funktionelle Bildgebungsstudien beim Menschen haben gezeigt, dass sich die Netzwerke, d. h. die beteiligten Regionen, nicht stark zwischen uni- und bimanuellen Bewegungen unterscheiden. Dahingegen haben Konnektivitätsuntersuchungen – also Untersuchungen, wie Areale miteinander interagieren – gezeigt, dass bei beidhändigen Bewegungen eine intensive Kopplung beider Hirnhemisphären auftritt und dass auch hier die SMA eine wichtige Integrationsrolle zu spielen scheint. Interessanterweise besitzt die linke SMA eine Dominanz über die rechte SMA, so dass einige Forscher hier ein biologisches Äquivalent für Händigkeit sehen.
Pyramidenbahn
Die Pyramidenbahn (Tractus corticospinalis) ist die Zusammenfassung aller Nervenzellfortsätze, die aus der primär-motorischen Rinde stammen und Befehle an das Rückenmark oder Hirnnervenkerne weiterleiten. Sie haben einen gemeinsamen und in sich wiederum somatotop gegliederten Verlauf. Rein funktionell betrachtet ist die Pyramidenbahn ein unmittelbarer Bestandteil der motorischen Rinde.
Die absteigenden Axone stammen zu ca. 25 % von kleineren Pyramidenzellen der primär-motorischen Rinde, weitere 30 % entstammen den sekundär- und supplementärmotorischen Arealen und 40 % haben ihr Soma sogar im somatosensorischen Cortex (Areae 1, 2, 3, 5 und 7 nach Brodmann). Nur etwa fünf Prozent gehen von den großen Betz-Riesenzellen des primären Motorcortex aus. Die somatosensorischen Fasern scheinen funktionell aber weniger bedeutsam zu sein, da sie keine monosynaptischen Verbindungen mit den motorischen Vorderhornzellen eingehen. Sie könnten jedoch eine wichtige Funktion für die Funktionserholung nach Hirnschädigungen, z. B. nach einem Schlaganfall, besitzen.
Neuronale Verbindungen
Afferenzen
Die zuführenden Bahnen des Motorcortex stammen vorwiegend aus dem Thalamus, insbesondere aus dessen ventralen Bezirken. Dort werden Informationen aus dem Kleinhirn und den Basalganglien sowie sensible Reize aus dem lemniskalen System zusammengefasst. Die Bahnen aus den Basalganglien (vor allem aus dem Globus pallidus) gelangen vorwiegend in die prä- und supplementär-motorische Rinde.
Über Assoziationsfasern, also Verbindungen innerhalb der Hirnrinde einer Hemisphäre, erhalten die prämotorischen Gebiete umfangreiche sensible und sensorische Informationen aus dem Parietallappen, die supplementär-motorischen Areale hingegen werden vor allem vom präfrontalen Cortex gespeist, der mit höheren kognitiven Leistungen (Bewusstsein, Absicht, Motivation) in Verbindung gebracht wird. Dies wird als Hinweis auf die Rolle der SMA als „Freigeber“ einer geplanten Bewegung interpretiert. Verbindungen aus dem Gyrus cinguli, der dem limbischen System zugerechnet wird, bestehen zu allen Teilen des Motorcortex.
Verbindungen innerhalb des Motorcortex
Innerhalb der motorischen Rinde verlaufen die Bahnen überwiegend von den prä- und supplementär-motorischen Feldern zur primär-motorischen Rinde. Die vorderen Anteile der PMA und SMA scheinen die Funktion der hinteren zu kontrollieren und gegebenenfalls zu hemmen, entsenden aber keine direkten Fasern in die M1.
Efferenzen
Die Riesenpyramidenzellen der primär-motorischen Rinde entsenden ihre Axone praktisch ausschließlich in die Pyramidenbahn, wo sie etwa 5 % der Fasern ausmachen. Zudem strahlen dort die Axone der kleinen präcentralen Pyramidenzellen (25–45 %) und Fasern aus der prämotorischen und supplementär-motorischen Rinde (5–10 %) sowie aus dem somatosensiblen Cortex (20–50 %) ein.[10][11] Kollateralen, das heißt Abzweigungen der Axone, der Motoneurone erreichen den Nucleus ruber und die Reticularis-Kerne des verlängerten Marks. Ein großer Teil der Bahnen endet zudem an den Kerngebieten der Pons und am Nucleus olivaris, von wo sie in das Kleinhirn weitergeleitet werden, oder verlässt bereits in der Capsula interna die Pyramidenbahn, um den Thalamus und das Corpus striatum anzusteuern. Der Anteil der Nervenzellfortsätze, die die Pyramidenbahn bis in das Rückenmark begleiten, liegt bei 15 %. Insgesamt verlassen die Axone von geschätzten zwei bis drei Millionen motorischen Neuronen die Großhirnrinde. Bei einer Gesamtzahl von rund zehn Milliarden Nervenzellen ist diese Zahl überraschend gering.
Die prä- und supplementär-motorischen Felder entsenden ungeachtet ihrer Verbindungen zum primär-motorischen Cortex auch Efferenzen zur Formatio reticularis des Hirnstammes. Von dort wird vorwiegend die tonisch aktive Rumpfmuskulatur gesteuert.
Pathologie
Folgen einer Läsion des Motorcortex
Eine Schädigung des ersten Motoneurons in der primär-motorischen Rinde führt unabhängig von der Schädigungsursache zu charakteristischen Bewegungsstörungen in den Muskelgruppen, die von dem betroffenen Rindenbezirk kontrolliert werden. Da die meisten absteigenden Bahnen (siehe Pyramidenbahn) im Hirnstamm auf die Gegenseite kreuzen (sogenannte Pyramidenkreuzung, Decussatio pyramidum), tritt die Lähmung normalerweise vor allem an der gegenüberliegenden Körperseite in Erscheinung (Hemiparese). Praktisch immer ist die Kontrolle der rumpffernen (distalen) Muskulatur ausgeprägter eingeschränkt als die der rumpfnahen (proximalen) Muskulatur. John Hughlings Jackson teilte die Bewegungsstörungen in Plus- und Minussymptome ein. Plussymptome sind:
- vermehrter muskulärer Widerstand bei passiver Bewegung (spastische Tonuserhöhung)
- gesteigerte Muskeleigenreflexe
- die Auslösbarkeit von pathologischen Reflexen wie dem Babinski-Zeichen
- Auftreten von Massenbewegungen sowie Mitbewegungen der Gegenseite
Zu dem Minussymptomen gehören:
- Minderung der entwickelten Muskelkraft (Parese)
- Beeinträchtigung selektiver Bewegungen und Verlust von Präzisionsbewegungen
- Beeinträchtigung der Fähigkeit zu schnell alternierenden Bewegungen (Dysdiadochokinese)
- Beeinträchtigung der Fähigkeit, die Kraft rasch zu entwickeln und längere Zeit konstant zu halten (motor impersistence).
Schädigungen der vorgelagerten Rindenareale kommen selten isoliert vor und führen zu komplexen Bewegungsstörungen. Ähnliche Störungen können auch bei Läsionen der parietalen Assoziationsrinde und – zumindest teilweise – bei krankhaften Prozessen der Basalganglien und des Kleinhirns auftreten:
- allgemeine koordinative Ungeschicklichkeit (Ataxie), die aber auch bei Kleinhirnschädigung oder sensiblem Defizit auftreten kann
- gestörtes Bewegungsgedächtnis
- Unfähigkeit, Bewegungspläne korrekt umzusetzen (ideokinetische Apraxie)
- Unfähigkeit, Bewegungspläne zu erstellen und dabei einzelne Handlungen sinnvoll und in der richtigen Reihenfolge zu kombinieren (ideatorische Apraxie)
- gestörte Einleitung einer Bewegung (Starthemmung), die auch beim Morbus Parkinson auftritt
Wichtige Krankheitsbilder
Die häufigste Ursache einer akuten Hirnschädigung mit motorischer Beeinträchtigung ist der Hirninfarkt durch Gefäßverschluss im Gebiet der mittleren Hirnarterie (Arteria cerebri media). Wenn die bei den meisten Menschen dominante linke Hemisphäre betroffen ist, kommt es oftmals zusätzlich zu Sprachstörungen (siehe Aphasie). Gleichzeitig vorliegende apraktische und ataktische Symptome werden nicht selten durch die Lähmung maskiert. Auch beim viel selteneren Verschluss der vorderen Hirnarterie (Arteria cerebri anterior) ist ein Teil des Motorcortex einbezogen, typischerweise (entsprechend dem Homunculus) der für die Kontrolle der unteren Extremität. Andere Ursachen für Schädigungen der motorischen Rinde sind Hirnblutungen, Entzündungen, Hirntumoren und Verletzungen.
Eine seltene Krankheit, die mit der Degeneration der corticalen Motoneurone einhergeht, ist die spastische Spinalparalyse. Auch bei Sauerstoffmangel während der Geburt kann eine Schädigung der empfindlichen Nervenzellen des Motorcortex auftreten, das daraus resultierende Krankheitsbild heißt infantile Zerebralparese. Eine neurodegenerative Erkrankung des älteren Menschen, die neben den Vorderhornzellen auch zentrale Motoneurone erfasst, ist die Amyotrophe Lateralsklerose.
Epilepsien sind kurz andauernde, anfallsartige Funktionsstörungen zahlreicher Nervenzellen. Beim generalisierten tonisch-klonischen Anfall (grand mal) wird die motorische Rinde beider Seiten massiv erregt. Folge ist – neben anderen Erscheinungen – das charakteristische „krampfhafte“ Zucken, das den gesamten Körper erfasst. Hingegen breiten sich bei einer anderen Form der Epilepsie, den fokalen Jackson-Anfällen, die Krampfpotentiale langsam über die primär-motorische Rinde nur einer Seite aus und führen somit – entsprechend der Somatotopie – zu einem „Wandern“ der Zuckungen (march of convulsion) über die Muskelgruppen einer Gliedmaße. Das Bewusstsein ist dabei erhalten. Nach Abklingen der Krampfpotentiale ist die motorische Funktion fast immer ungestört. Eine Ausnahme hiervon ist die Toddsche Lähmung, die einen Schlaganfall imitieren kann.
Evolutionäre Aspekte
Im Laufe der Evolution ist eine Tendenz zur Ausbildung einer immer höheren Komplexität der Gehirnstrukturen und zur zunehmenden Verlagerung von Steuerungsprozessen in die Hirnrinde (corticalisation) festzustellen. Der Motorcortex ist eine relativ junge Entwicklung und kommt nur bei Säugetieren vor. Die Ausführung von Bewegungen wird bei Fischen, Amphibien, Reptilien und auch Vögeln von einem als Archistriatum bezeichneten Kerngebiet im Gehirn gesteuert, bei Säugern entspricht dem das Corpus striatum, das auch hier an Bewegungsabläufen beteiligt ist.
Besonders Primaten haben ein ausgeprägtes motorisches Rindengebiet. Zudem besitzen sie – anders auch als alle anderen Säuger – viele monosynaptische, also direkte Verbindungen des Motorcortex zu den Motoneuronen im Hirnstamm und Rückenmark. Daraus lässt sich ableiten, dass die bewusste, geplante und fein abgestufte Bewegung einzelner Muskeln nur ihnen möglich ist, während bei den meisten Tieren Bewegungsprogramme wahrscheinlich „automatischer“ und ohne große willkürliche Eingriffsmöglichkeiten ablaufen. Huftiere besitzen im Vergleich dazu eine schwach entwickelte Pyramidenbahn, die bereits in der Halsschwellung des Rückenmarks (Intumescencia cervicalis) endet und vor allem für die Mimik eine Rolle spielt. Bei Hunden erreichen zwar noch etwa 30 % der pyramidalen Fasern die Lendenschwellung des Rückenmarks (Intumescencia lumbalis), allerdings enden die Fasern immer an Interneuronen, nie direkt an der Vorderhornzelle. Eine komplette Schädigung des Motorcortex einer Seite führt daher bei fast allen Nicht-Primaten nie zu Plegien, sondern zu kontralateralen Störungen der Haltungs- und Stellreaktionen.
Beim Menschen hat sich in seiner evolutionären Entwicklung insbesondere die Steuerung der Hand und der Sprechmuskulatur immer weiter verfeinert. Er besitzt zudem ein im Tierreich einmalig hohes Potential, lebenslang neue Bewegungsabläufe zu erlernen.
Geschichte
Im Prinzip war schon seit 1870 bekannt, dass die Reizung bestimmter Rindenfelder zu definierten motorischen Reaktionen führt: Gustav Theodor Fritsch und Eduard Hitzig hatten damals aufschlussreiche Experimente am Hund durchgeführt,[12] deren Ergebnisse von David Ferrier durch Versuche am Affen bestätigt und konkretisiert werden konnten.[13] John Hughlings Jackson hingegen leitete allein aus der genauen Beobachtung fokaler Anfälle (vor allem der oben geschilderten und nach ihm benannten Jackson-Anfälle) im Wesentlichen zutreffende Theorien über die Organisation der motorischen Systeme ab. Die Entdeckung der Bedeutung und der somatotopen Gliederung der primär-motorischen Rinde beim Menschen geht auf den kanadischen Neurochirurgen Wilder Penfield zurück. Durch schwache elektrische Reizung der Hirnrinde von wachen Patienten bei offener Schädelkalotte (das Gehirn selbst ist nicht schmerzempfindlich) konnte er die Lage einiger Funktionen klären. 1949 entdeckte er so, dass sich durch Stimulation des Gyrus praecentralis Zuckungen in konkreten Muskelgruppen auslösen lassen.[14]
Bedeutung
Die außerordentliche Bedeutung der motorischen Areale – auch hinsichtlich philosophischer Erwägungen – liegt darin, dass sie gewissermaßen die Schnittstelle zwischen Bewusstsein und Materie darstellen. Nur über diese Verbindung ist der Mensch in der Lage, absichtsvoll und gerichtet seine Umwelt zu beeinflussen, sich fortzubewegen und Kontakt zu anderen Individuen aufzunehmen. Eindrucksvoll offenbart sich die Wichtigkeit des Motorcortex dann, wenn bei vollständigem Verlust seiner Funktion – in der Regel durch Läsion der absteigenden (efferenten) Bahnen – jede willkürliche Kontrolle über den Körper verloren geht. Patienten mit dem so genannten Locked-in-Syndrom sind bei vollem Bewusstsein und nehmen ihre Umwelt wahr, können aber nicht mehr reagieren und sind somit praktisch völlig in sich selbst eingeschlossen (locked in). Lediglich über vertikale Augenbewegungen ist noch eine Verständigung möglich.
Ausblick
Derzeit gibt es vielversprechende Versuche, gelähmten Menschen mit intaktem Motorcortex (z. B. infolge einer Querschnittsverletzung) über sogenannte Brain-Computer-Interfaces einen (allerdings sehr begrenzten) Aktionsrahmen zurückzugeben. Die neuromotorischen Prothesen werden direkt auf die Hirnoberfläche im Gebiet der primär-motorischen Rinde gesetzt. Sie bestehen aus einem Feld von kleinen Elektroden, die die Potentiale abgreifen, die bei einer Bewegung entstehen (movement-related potential). Auch wenn die physiologische Fortleitung unterbrochen ist, können so eventuell in Zukunft in einem begrenzten Umfang tetraplegisch Gelähmten Handlungsoptionen gegeben werden, wie hier beispielsweise die Steuerung eines Cursors am Computerbildschirm oder die Kontrolle eines Roboterarms.[15]
Literatur
- Otto Detlev Creutzfeldt: Cortex cerebri. Springer, Berlin 1983. ISBN 3-540-12193-5.
- Walle Nauta, Michael Feirtag: Neuroanatomie. Eine Einführung. Spektrum, Heidelberg 1991, ISBN 3-89330-707-9.
- Karl Zilles, G. Rehkämper: Funktionelle Neuroanatomie. Springer, Berlin 1993, ISBN 3-540-54690-1.
- Detlev Drenckhahn, W. Zenker: Benninghoff. Anatomie. Urban & Schwarzenberg, München 1994, ISBN 3-541-00255-7.
- Alexa Riehle, Eilon Vaadia: Motor Cortex in Voluntary Movements (Methods and New Frontiers in Neuroscience). CRC Press, 2004, ISBN 0-8493-1287-6.
Weblinks
Einzelnachweise
- nach K. Zilles, G. Rehkämper: Funktionelle Neuroanatomie. Springer, Berlin 1993, ISBN 3-540-54690-1.
- nach D. Drenckhahn, W. Zenker (Hrsg.): Benninghoff. Anatomie. 15. Aufl. Urban & Schwarzenberg, München 1994, ISBN 3-541-00255-7.
- C. Grefkes, G.R. Fink: The functional organization of the intraparietal sulcus in humans and monkeys. In: J Anat., 2005, 207(1), S. 3–17, PMID 16011542.
- Giacomo Rizzolatti et al.: Premotor cortex and the recognition of motor actions. In: Brain Res Cogn Brain Res., 1996, 3(2), S. 131–141, PMID 8713554.
- R. Hari et al.: Activation of human primary motor cortex during action observation: a neuromagnetic study. In: Proc Natl Acad Sci U S A., 1998, 95(25), S. 15061–5, PMID 9844015.
- U. Halsband, R. K. Lange: Motor learning in man: A review of functional and clinical studies. In: J Physiol Paris., 2006, 99(4-6), S. 414–424, PMID 16730432.
- R. Q. Cui, L. Deecke: High resolution DC-EEG analysis of the Bereitschaftspotential and post movement onset potentials accompanying uni- or bilateral voluntary finger movements. In: Brain Topogr., 1999, 11(3), S. 233–249, PMID 10217447.
- I. Kermadi et al.: Effects of reversible inactivation of the supplementary motor area (SMA) on unimanual grasp and bimanual pull and grasp performance in monkeys. In: Somatosens Mot Res., 1997, 14(4), S. 268–280, PMID 9443367.
- Hans Helmut Kornhuber, Lüder Deecke: Hirnpotentialänderungen bei Willkürbewegungen und passiven Bewegungen des Menschen: Bereitschaftspotential und reafferente Potentiale. In: Pfuegers Arch., 1965, 281, S. 1–17
- M. Wiesendanger: Organization of secondary motor areas of the cerebral cortex. In: J. M. Brookhart, V. B. Mountcastle: Handbook of Physiology. American Physiol. Society, Bethesda MA 1981
- K. Toyoshima, H. Sakai: Exact cortical extent of the origin of the corticospinal tract (CST) and the quantitative contribution to the CST in different cytoarchitectonic areas. A study with horseradish peroxidase in the monkey. In: J Hirnforsch., 1982, 23(3), S. 257–269
- Gustav Theodor Fritsch, Eduard Hitzig: Über die elektrische Erregbarkeit des Grosshirns. In: : Archiv für Anatomie, Physiologie und wissenschaftliche Medicin, 1870, S. 300–332.
- David Ferrier: The functions of the brain. London (1876)
- Wilder Penfield, Theodore Rasmussen: The Cerebral Cortex of Man. A Clinical Study of Localization of Function. The Macmillan Comp. New York, 1950
- L. R. Hochberg et al.: Neuronal ensemble control of prosthetic devices by a human with tetraplegia. In: Nature, 442, 2006, S. 164–171, Abstract (englisch)