α-Synuclein
α-Synuclein (auch α-Synuklein, SNCA) ist ein kleines, lösliches Protein im Gehirn von Wirbeltieren, das unter anderem die Dopamin-Ausschüttung reguliert. Es ist in der Lage, Membrankanäle zu bilden und ist daher ein Transportprotein. Mutationen im SNCA-Gen sind verantwortlich für Synucleinopathien, wie die erblichen Formen 1 und 4 der Parkinson-Krankheit und der Lewy-Körperchen-Demenz.[2][3][4][5]
| Α-Synuclein | ||
|---|---|---|
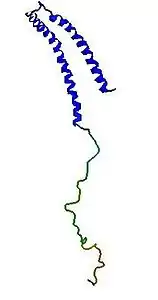 | ||
|
Vorhandene Strukturdaten: 1XQ8 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 140 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name | SNCA | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 1.C.77.1.1 | |
| Bezeichnung | Synuclein-Familie | |
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Funktion
Wie der Name impliziert, wurde SNCA initial als synaptisches und nukleäres Protein identifiziert.[6] Trotz intensiver Studien ist die genaue Rolle von SNCA noch nicht klar definiert: Es gibt Anzeichen dafür, dass SNCA bei der Aufrechterhaltung des synaptischen Vesikel-Pools eine Rolle spielt und die Dopaminfreisetzung moduliert, aber SNCA-knockout-Mäuse haben keinen offensichtlichen Phänotyp.[7][8]
Primärstruktur
Die Primärstruktur von α-Synuclein wird in drei verschiedene Domänen unterteilt:[9]
- Aminosäuren 1–60: Das charakteristische dieses N-terminalen, amphipathischen Abschnitts ist eine Sequenz von elf Aminosäuren, welche vier Mal wiederholt wird. Diesen Abschnitten ist gemein, dass sie jeweils die Konsensussequenz KTKEGV besitzen. Die resultierende Sekundärstruktur dieser Sequenz ist eine α-Helix, sie ähnelt Domänen, die an Apolipoproteine binden.
- Aminosäuren 61–95: Dieser Abschnitt ist hydrophob und besitzt die sogenannte non-amyloid-β component (NAC) Region, welche in die Proteinaggregation involviert ist. Zusätzlich sind drei weitere KTKEGV-Wiederholungen zu finden.
- Aminosäuren 96–140: In diesem Abschnitt sind viele Aminosäuren mit saurem Rest aber auch Prolin zu finden. Dieser C-terminale Abschnitt zeigt keine Tendenz eine bestimmte Sekundärstruktur zu bilden.
Pathologie
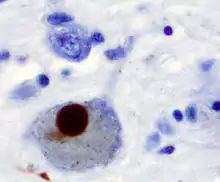
α-Synuclein wurde im menschlichen Gehirn als Vorstufe des nicht-Amyloid-β-Proteins identifiziert. Wissenschaftler des US-amerikanischen National Human Genome Research Institute (NHGRI) an den National Institutes of Health (NIH) in Bethesda, Maryland haben 1997 herausgefunden, dass es an mehreren pathogenen Prozessen bei neurodegenerativen Erkrankungen wie zum Beispiel dem Morbus Parkinson beteiligt ist. So wurde in den für letztere typischen Lewy-Körperchen eine positive Immunreaktion für Antikörper gegen α-Synuclein gefunden.[10] Diesem Protein wird eine toxische Wirkung auf bestimmte Nervenzellen, vor allem aber auf dopaminerge Neurone der Substantia nigra zugeschrieben, in denen es in Form von Protofibrillen als Mitverursacher oxidativen Stresses und daraus resultierenden neuronalen Zelltodes angesehen wird.[11] Auch eine Bedeutung der α-Synucleine bei der Entstehung von Prionkrankheiten oder der Alzheimerschen Krankheit wird diskutiert.
Die Gruppe neurodegenerativer Erkrankungen, bei denen es zu einer pathologischen Akkumulation von α-Synuclein im zentralen Nervensystem kommt, bezeichnet man als Synucleinopathien.
Die Wiener Firma AFFiRiS AG führt seit dem 5. Juni 2012 eine klinische Studie mit dem gegen α-Synuclein gerichteten Wirkstoff PD01A durch mit dem Ziel, einen Impfstoff gegen die Parkinsonsche Erkrankung zu entwickeln. Durch die Impfung soll das Immunsystem angeregt werden, Antikörper gegen α-Synuclein zu bilden.[12][13]
Literatur
- M. H. Polymeropoulos, C. Lavedan, E. Leroy et al.: Mutation in the alpha-synuclein gene identified in families with Parkinson’s disease. In: Science. Band 276, Nr. 5321, Juni 1997, S. 2045–2047, doi:10.1126/science.276.5321.2045, PMID 9197268.
- Manuela Neumann, Philipp J. Kahle, Benoit I. Giasson et al.: Misfolded proteinase K-resistant hyperphosphorylated alpha-synuclein in aged transgenic mice with locomotor deterioration and in human alpha-synucleinopathies. In: The Journal of Clinical Investigation. Band 110, Nr. 10, November 2002, ISSN 0021-9738, S. 1429–1439, doi:10.1172/JCI15777, PMID 12438441, PMC 151810 (freier Volltext).
- Sandra Blakeslee: In Folding Proteins, Clues to Many Diseases. In: The New York Times. 21. Mai 2002 (nytimes.com).
- Ahmad Jowaed, Ina Schmitt, Oliver Kaut, Ullrich Wüllner: Methylation regulates alpha-synuclein expression and is decreased in Parkinson’s disease patients’ brains. In: The Journal of Neuroscience. Band 30, Nr. 18, Mai 2010, ISSN 1529-2401, S. 6355–6359, doi:10.1523/JNEUROSCI.6119-09.2010, PMID 20445061.
- Kelvin C. Luk, Victoria Kehm, Jenna Carroll, Bin Zhang, Patrick O’Brien, John Q. Trojanowski, Virginia M.-Y. Lee: Pathological α-Synuclein Transmission Initiates Parkinson-like Neurodegeneration in Non-transgenic Mice. In: Science. Band 338, Nr. 6109, 2012, S. 949–953, doi:10.1126/science.1227157, PMID 23161999, PMC 3552321 (freier Volltext).
Quellen
- Homologe zu P37840 bei OMA
- Julia M. George: The synucleins. In: Genome Biology. Band 3, Nr. 1, 2002, S. reviews3002.1–reviews3002.6, PMID 11806835, PMC 150459 (freier Volltext).
- C. Lavedan: The synuclein family. In: Genome Research. Band 8, Nr. 9, September 1998, S. 871–880, doi:10.1101/gr.8.9.871, PMID 9750188 (genome.org [PDF; 188 kB]).
- UniProt P37840
- (Seite nicht mehr abrufbar, Suche in Webarchiven: Pathway DB: Alpha-synuclein signaling.)
- L. Maroteaux, J. T. Campanelli, R. H. Scheller: Synuclein: a neuron-specific protein localized to the nucleus and presynaptic nerve terminal. In: The Journal of Neuroscience. Band 8, Nr. 8, August 1988, ISSN 0270-6474, S. 2804–2815, PMID 3411354.
- A. Abeliovich, Y. Schmitz, I. Fariñas, D. Choi-Lundberg, W. H. Ho, P. E. Castillo, N. Shinsky, J. M. Verdugo, M. Armanini, A. Ryan, M. Hynes, H. Phillips, D. Sulzer, A. Rosenthal: Mice lacking alpha-synuclein display functional deficits in the nigrostriatal dopamine system. In: Neuron. Band 25, Nr. 1, Januar 2000, S. 239–252, PMID 10707987.
- D. D. Murphy, S. M. Rueter, J. Q. Trojanowski, V. M. Lee: Synucleins are developmentally expressed, and alpha-synuclein regulates the size of the presynaptic vesicular pool in primary hippocampal neurons. In: The Journal of Neuroscience. Band 20, Nr. 9, Mai 2000, ISSN 1529-2401, S. 3214–3220, PMID 10777786.
- Leonid Breydo, Jessica W. Wu, Vladimir N. Uversky: Α-synuclein misfolding and Parkinson’s disease. In: Biochimica Et Biophysica Acta. Band 1822, Nr. 2, Februar 2012, ISSN 0006-3002, S. 261–285, doi:10.1016/j.bbadis.2011.10.002, PMID 22024360.
- A. Brunn: Vorlesung Allgemeine Pathologie. Abteilung für Neuropathologie, Universität zu Köln, Sommersemester 2005. medizin.uni-koeln.de (Memento vom 24. April 2009 im Internet Archive) (PDF).
- M. Tolnay: α-Synuclein und Tau: abnorme Proteinablagerungen beim Parkinson-(plus)-Syndrom. In: Schweiz. Arch. Neurol. Psychiatr. Band 151, 2000, S. 136–145 (sanp.ch PDF).
- Parkinson-Impfstoff – weltweit erste klinische Studie in Wien. AFFiRiS AG, 5. Juni 2012, archiviert vom Original am 11. Juni 2012; abgerufen am 11. Juni 2012.
- Thomas H. Maugh: First trial of vaccine to treat Parkinson’s disease begins. In: Los Angeles Times. 7. Juni 2012, abgerufen am 11. Juni 2012 (englisch).