Wieland-Miescher-Keton
Das Wieland-Miescher-Keton ist eine organisch-chemische Verbindung. Es handelt sich um ein bicyclisches Diketon, das außer einer Doppelbindung gesättigt ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
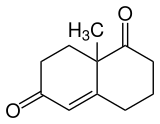 | ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Wieland-Miescher-Keton | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C11H14O2 | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 178,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Das Wieland-Miescher-Keton ist nach seinen Entdeckern Peter Wieland und Karl Miescher benannt, die es bei Ciba-Geigy entwickelten.[3] Das eigentliche Wieland-Miescher-Keton wird racemisch durch eine Robinson-Anellierung gewonnen, von pharmazeutischem Interesse ist jedoch die enantiomerenreine Darstellung.
Isomerie
Das Wieland-Miescher-Keton ist eine chirale Verbindung mit einem Stereozentrum am C8a-Atom. Folglich existieren die zwei enantiomeren Formen (R)-Wieland-Miescher-Keton und (S)-Wieland-Miescher-Keton.
| Stereoisomere des Wieland-Miescher-Ketons | ||
| Name | (R)-Wieland-Miescher-Keton | (S)-Wieland-Miescher-Keton |
| Andere Namen | (−)-Wieland-Miescher-Keton | (+)-Wieland-Miescher-Keton |
| Strukturformel | -Wieland-Miescher_ketone.svg.png.webp) | -Wieland-Miescher_ketone.svg.png.webp) |
| CAS-Nummer | 100348-93-4 | 33878-99-8 |
| 20007-72-1 (unspez.) | ||
| PubChem | 736070 | 736069 |
| 89262 (unspez.) | ||
| Wikidata | – | – |
| Q413602 (unspez.) | ||
Darstellung
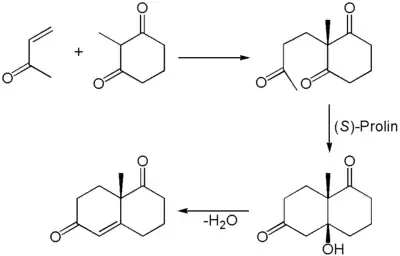
Das Wieland-Miescher-Keton wurde erstmals durch eine Robinson-Anellierung hergestellt. Der zweite Schritt der Robinson-Anellierung (Aldol-Reaktion) wurde hierbei auf organokatalytischem Wege über die Eder-Sauer-Wiechert-Hajos-Parrish-Reaktion durchgeführt. Als Organokatalysator diente enantiomerenreines (S)-Prolin, wodurch das Produkt mit hoher Enantioselektivität erhalten werden konnte.[4]
Die Synthese kann auch als Eintopfreaktion durchgeführt werden.[5] Das Aldol-Zwischenprodukt wurde nur von Hajos und Parrish isoliert und in ihrem Patent beschrieben.[6][7]
Verwendung
Das Wieland-Miescher-Keton ist von synthetischem Interesse für die pharmazeutische Industrie. Es dient als Ausgangsverbindung zur Totalsynthese von Steroiden.
Siehe auch
Einzelnachweise
- Datenblatt (±)-3,4,8,8a-Tetrahydro-8a-methyl-1,6(2H,7H)-naphthalenedione, 98+% bei AlfaAesar, abgerufen am 1. Dezember 2019 (PDF) (JavaScript erforderlich).
- Datenblatt (±)-8a-Methyl-3,4,8,8a-tetrahydro-1,6(2H,7H)-naphthalenedione, 98% bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- P. Wieland, K. Miescher: Über die Herstellung mehrkerniger Ketone. In: Helv. Chim. Acta, 1950, 33, S. 2215, doi:10.1002/hlca.19500330730.
- P. Buchschacher, A. Fürst, J. Gutzwiller: (S)-3,4,8,8a-tetrahydro-8a-methyl-1,6(2H,7H)-naphthalenedione In: Organic Syntheses. 63, 1985, S. 37, doi:10.15227/orgsyn.063.0037; Coll. Vol. 7, 1990, S. 368 (PDF).
- T. Bui, C. F. Barbas: A proline-catalyzed asymmetric Robinson annulation reaction. In: Tetrahedron Letters, 2000, 41, S. 6951–6954; doi:10.1016/S0040-4039(00)01180-1.
- Patent DE2102623: Werkwijze voor de bereiding van 1,3-dioxycycloalkanen. Veröffentlicht am 29. Juli 1971, Erfinder: Zoltan George Hajos, David Richard Parrish.
- Patent US3975440: Asymmetric synthesis of organic compounds. Veröffentlicht am 17. August 1976, Erfinder: Zoltan George Hajos, David Richard Parrish.