Robinson-Anellierung
Die Robinson-Anellierung ist eine Namensreaktion der Organischen Chemie und benannt nach dem britischen Chemiker und Träger des Nobelpreises für Chemie Robert Robinson. Die Reaktion ermöglicht es, Ketone und α,β-ungesättigte Ketone im basischen Milieu umzusetzen. Dabei wird ein Sechsring gebildet und es wird ermöglicht, organische Verbindungen um einen Sechsring zu erweitern. Andere Ringgrößen sind dabei nicht möglich.[1] Die Robinson-Anellierung besteht dabei aus zwei entscheidenden Reaktionsschritten: einer Michael-Addition und der anschließenden Aldolkondensation.[2]
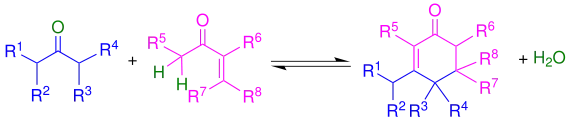
Reaktionsmechanismus
Die Robinson-Anellierung wird in diesem Abschnitt anhand eines Cyclohexanonderivats und einem ungesättigten Pentanon erklärt.
Die ersten Schritte der Robinson-Anellierung sind der Michael-Addition gleich. Das Cyclohexanon-Derivat 1 wird zunächst durch eine Base in α-Stellung zur Carbonylgruppe deprotoniert. Dabei entsteht das Enolat 2, welches nucleophil das α,β-ungesättigte Keton angreift. Nach Protonierung entstehen das 1,5-Diketon 4 sowie erneut die Base, was dessen Rolle als Katalysator zeigt. Die weiteren Schritte gehören zu einer Aldolreaktion. Das 1,5-Diketon 4 wird erneut durch die Base in α-Stellung deprotoniert. Daraufhin findet ein Ringschluss statt, indem das Enolat 5 die andere im Molekül befindliche Carbonylgruppe angreift. Nach Protonierung des Alkoholates 6 bildet sich das β-Hydroxyketon 7 (Aldol), das unter Wasserabspaltung das α,β-ungesättigte Keton 8 ergibt.[3]
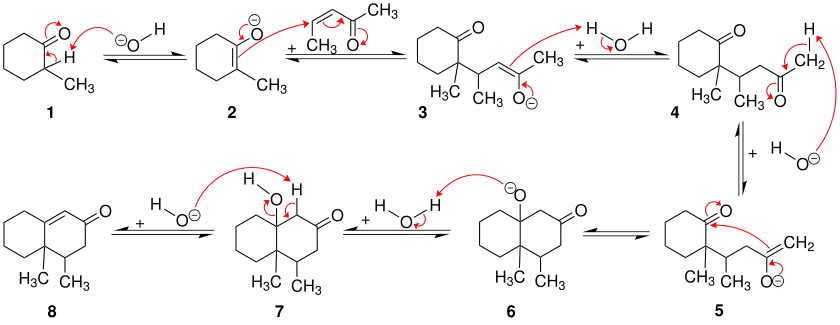
Nach Abschluss der Reaktion entsteht wieder eine ungesättigte Carbonylverbindung, die als sogenannter Michaelakzeptor als Ausgangspunkt für eine weitere Robinson-Anellierung dienen kann. Diese Methode eignet sich insbesondere zum Aufbau von Steroidgerüsten.
Varianten
Das Wieland-Miescher-Keton ist an sich racemisch.[4] Wenn man die Robinson-Anellierung jedoch mit Hilfe von L- oder D-Prolin katalysiert – also einen chiralen enantiomerenreinen organischen Katalysator einsetzt – entsteht in einer enantioselektiven Reaktion (Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion genannt) das (R)- oder (S)-Enantiomer des Wieland-Miescher-Ketons bevorzugt.[5]
Literatur
- Bergmann, E. D.; Gingberg, D.; Pappo, R. Org. React. 1959, 10, 179.
Einzelnachweise
- Rapson, William Sage; Robinson, Robert: In 307. Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones, Journal of the Chemical Society 1935, 1285 doi:10.1039/JR9350001285.
- K. P. C. Vollhardt, N. E. Schore, Organische Chemie, 4. Auflage, Wiley-VCH Verlag, 2005, S. 944, ISBN 3-527-31380-X.
- Organikum, 16. Auflage, VEB Deutscher Verlag der Wissenschaften Berlin 1985, S. 511, ISBN 3-326-00076-6.
- Wieland, P.; Miescher, K.: In Über die Herstellung mehrkerniger Ketone., Helv. Chim. Acta 1950, 33, 2215. doi:10.1002/hlca.19500330730.
- Hajos, Zoltan G., Parrish, David R. Deutsche Offenlegungsschrift 2102623 (21. Januar 1970).