Tsuji-Trost-Reaktion
Die Tsuji-Trost-Reaktion[1][2] oder Trost-Allylierung, auch häufig einfach Allylische Alkylierung genannt, ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Es handelt sich dabei um eine Palladium-katalysierte Alkylierung von Allylverbindungen. Sie dient meist der Einführung von Alkoholen, Aminen oder Derivaten von Phenol. Als Edukte werden Verbindungen benötigt, die eine Abgangsgruppe in allylischer Position besitzen. Sie wurde nach Jiro Tsuji und Barry Trost benannt.
Reaktionsmechanismus
Zunächst bildet das eingesetzte Alken mit dem Palladiumkatalysator einen π-Komplex. Bei einer oxidativen Addition wird unter Inversion und Abspaltung der Abgangsgruppe ein η3-π-Allylkomplex gebildet. Dieser Schritt wird auch als Ionisierung bezeichnet. Je nach Härte des Nucleophils findet anschließend einer von zwei weiteren Reaktionsverläufen statt:
Bei weichen Nucleophilen, die von konjugierten Säuren mit einem pKa-Wert kleiner 25 gebildet werden, addiert sich das Nucleophil für gewöhnlich direkt am Allyl. Die nucleophile Addition findet erneut unter Inversion statt. Bei der anschließenden Ligandendissoziation wird das alkylierte Allyl freigesetzt und der Katalysator zurückgebildet.
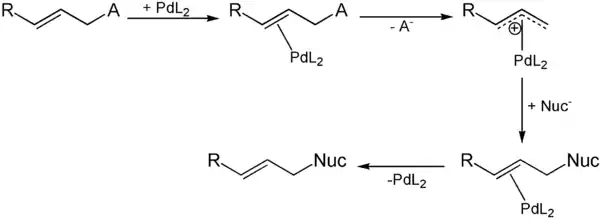
Edukte und Katalysatoren
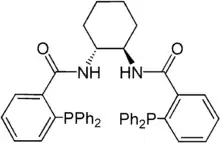
Der benötigte Palladiumkatalysator der Oxidationsstufe 0 wird in situ erzeugt. Als Liganden eignen sich Phosphinliganden, beispielsweise der Trost-Ligand oder Triphenylphosphan.
Als allylische Ausgangsstoffe kommen alle Allyle mit elektronenarmen, also guten Abgangsgruppen, wie Acetate oder Bromide, in Frage. Bei der Verwendung von Carbonaten als Abgangsgruppe kann darüber hinaus auf den Einsatz einer zusätzlichen Base verzichtet werden (build in base). Als Nucleophil können zum Beispiel aktivierte Methylene, Enolate, Amine oder Phenole eingesetzt werden.
Zur Einführung von Hydroxygruppen kann Wasser als Nucleophil verwendet werden, Ether können unter Einsatz von Alkoholen erhalten werden. Zur Einführung von Aminen eignen sich Phthalimidsalze. Aus dem erhaltenen Produkt kann in einem weiteren Reaktionsschritt das gewünschte Amin freigesetzt werden.
Asymmetrische Reaktion
Zur asymmetrischen Tsuji-Trost-Reaktion, auch Trostsche asymmetrische allylische Alkylierung genannt, werden Metallkomplexe mit enantiomerenreine chiralen Liganden als Katalysatoren eingesetzt.[3][4][5][6] Bei der Reaktion kommt es am Stereozentrum zur Inversion.
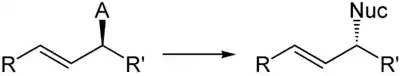
Die Reaktion wurde unter anderem als ein enantioselektiver Schlüsselschritt bei der Totalsynthese von Galantamin und Morphin eingesetzt.[7]
Modifikation der asymmetrischen Reaktion
Die komplementäre Reaktion wurde von Günter Helmchen entwickelt.[8][9][10] Unter Verwendung von Iridiumkatalysatoren mit chiralen Phosphoramiditliganden können aus achiralen internen Alkenen chirale terminale Alkene synthetisiert werden. Das Nucleophil greift hierbei im Gegensatz zur Trost-Allylierung nicht an der Position an, die die Abgangsgruppe getragen hat, was auf die unterschiedlichen elektronischen Eigenschaften von Palladium und Iridium zurückzuführen ist. Als Abgangsgruppen können ebenfalls Carbonsäureanionen verwendet werden, meistens werden jedoch organische Carbonate eingesetzt. Ähnliche Reaktionen können auch mit Molybdän- und Iridiumkatalysatoren durchgeführt werden. Diese Reaktionen bieten im Gegensatz zur Tsuji-Trost Reaktion auch Zugang zu verzweigten Regioisomeren.[11]
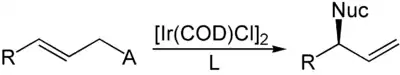
Einzelnachweise
- B. M. Trost, Pure Appl. Chem. 1981, 53, 2357 (PDF).
- J. Tsuji, Pure Appl. Chem. 1982, 54, 197 (PDF).
- B. M. Trost, T. J. Fullerton: New synthetic reactions. Allylic alkylation., in: J. Am. Chem. Soc. 1973, 95, 292–294.
- B. M. Trost, T. J. Dietsch: New synthetic reactions. Asymmetric induction in allylic alkylations., in: J. Am. Chem. Soc. 1973, 95, 8200–8201.
- B. M. Trost, P. E. Strege: Asymmetric induction in catalytic allylic alkylation., in: J. Am. Chem. Soc. 1977, 99, 1649–1651.
- B. M. Trost, M. L. Crawley: Asymmetric Transition-Metal-Catalyzed Allylic Alkylations:Applications in Total Synthesis, in: Chem. Rev. 2003, 103, 2921–2944.
- B. M. Trost, W. Tang, F. D. Toste: Divergent Enantioselective Synthesis of (−)-Galanthamine and (−)-Morphine., in: J. Am. Chem. Soc. 2005, 127, 14785–14803.
- J. P. Janssen, G. Helmchen: First Enantioselective Alkylations of Monosubstituted Allylic Acetates Catalyzed by Chiral Iridium Complexes, in: Tetrahedron Lett. 1997, 109, 8025–8026.
- B. Bartels, G. Helmchen: Ir-catalysed allylic substitution: mechanistic aspects and asymmetric synthesis with phosphorus amidites as ligands, in: Chem. Commun. 1999, 741–742.
- G. Lipowsky, N. Miller, G. Helmchen: Regio- und enantioselektive Iridium-katalysierte allylische Alkylierung mit in situ aktivierten P,C-Chelatkomplexen, in: Angew. Chem. 2004, 116, 4695–4698.
- A. Leitner, C. Shu, J. F. Hartwig, Org. Lett. 2005, 7, 1093–1096.