Trimethylsilyldiazomethan
Trimethylsilyldiazomethan ist eine organische chemische Verbindung aus der Gruppe der Azoverbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
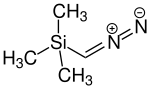 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylsilyldiazomethan | |||||||||||||||
| Andere Namen |
(Diazomethyl)trimethylsilan | |||||||||||||||
| Summenformel | C4H10N2Si | |||||||||||||||
| Kurzbeschreibung |
gelblich-grüne Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,718 g·cm−3 (25 °C)[1] | |||||||||||||||
| Siedepunkt |
96 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4362 (25 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Trimethylsilyldiazomethan kann ausgehend von Trimethylsilylmethylmagnesiumchlorid durch eine Grignard-Reaktion mit Diphenylazidophosphat gewonnen werden.[4]
Es wurde erstmals 1968 durch Dietmar Seyferth synthetisiert.[5]
Eigenschaften
Trimethylsilyldiazomethan ist eine gelblich grüne Flüssigkeit,[1] die unlöslich in Wasser aber löslich in den meisten organischen Lösungsmitteln ist.[2] Es ist in reiner Form oder in Kohlenwasserstofflösung stabil, zersetzt sich aber schnell bei Kontakt mit Tetrachlorkohlenstoff oder wenn es Licht ausgesetzt wird. Es wird nicht durch neutrales Wasser oder 20%ige Kalilauge verseift. Es kann eine Reihe von Reaktionen eingehen, wie zum Beispiel mit Carbonsäuren, Cyclohexen oder aktivierte Olefinen.[1]
Verwendung
Trimethylsilyldiazomethan wird als Ersatzstoff für Diazomethan zur Derivatisierung von Phenolen in Gegenwart von Diisopropylamin, Triethylamin oder anderen verwendet. Es dient auch bei organischen Synthesen zur Veresterung von verschiedenen natürlich vorkommenden Carbonsäuren, der Homologisierung von Aldehyden, als Reagenz bei der Arndt-Eistert-Homologisierung und als Reagenz bei weiteren Reaktionen. Es wandelt auch sterisch stark gehinderte Alkohole in die entsprechenden Methylether.[5][1] So wird es zum Beispiel bei der Herstellung von Macrolactam-Analoga von natürlichen Makroliden und Aigialomycin-Analoga eingesetzt.[6]
Sicherheitshinweise
Trimethylsilyldiazomethan wird als gebrauchsfertige Lösung in Hexan oder Diethylether in den Handel gebracht.[2] Es besitzt im Gegensatz zu Diazomethan keine Explosionsneigung, ist allerdings ebenfalls krebserzeugend und ein starkes Atemgift.[7]
Einzelnachweise
- U.S. Department of Health and Human Services: NTP Chemical Information Review Document for Trimethylsilyldiazomethane.
- Philip L. Fuchs: Reagents for Silicon-Mediated Organic Synthesis. John Wiley & Sons, 2011, ISBN 978-0-470-71023-4 (books.google.com).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Takayuki Shioiri, Toyohiko Aoyama und Shigehiro Mori: Trimethylsilyldiazomethane In: Organic Syntheses. 68, 1990, S. 1, doi:10.15227/orgsyn.068.0001; Coll. Vol. 8, 1993, S. 612 (PDF).
- Alessandro Dondoni: Advances in the Use of Synthons in Organic Chemistry: A Research Annual. Elsevier, 2013, ISBN 978-1-4831-0094-4, S. 52 (books.google.com).
- Datenblatt (Trimethylsilyl)diazomethane solution, 2.0 M in hexanes bei Sigma-Aldrich, abgerufen am 16. Juni 2014 (PDF).
- Gefahrstoffe in Praktika (Memento vom 22. Januar 2015 im Internet Archive).