Trimethylphosphit
Trimethylphosphit (TMPI) oder auch Phosphorigsäuretrimethylester ist eine farblose, übelriechende, giftige Flüssigkeit, die der Stoffgruppe der Phosphite angehört. Es kann zum Beispiel in der Arbuzov-Reaktion zur Herstellung von Phosphonaten und in der Perkow-Reaktion zur Synthese von Vinylphosphonaten verwendet werden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
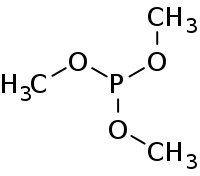 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylphosphit | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H9O3P | |||||||||||||||
| Kurzbeschreibung |
farblose, pyridinartig (in geringeren Konzentrationen stechend) riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 124,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,05 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
111 °C (1013 hPa)[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4095 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 2 ml·m−3 bzw. 10 mg·m−3[3] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung und Gewinnung
Trimethylphosphit kann leicht durch die Umsetzung von Phosphortrichlorid mit Methanol erhalten werden.[4]

Eigenschaften
Physikalische Eigenschaften
Trimethylphosphit ist eine farblose Flüssigkeit, die bei Normaldruck bei 111 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend ln(P) = A−(B/(T+C)) (P in Pa, T in K) mit A = 20,15306, B = 2519,7227 und C = −89,44893 im Temperaturbereich von 302 bis 343 K[5]
Trimethylphosphit bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 23 °C.[1] Der Explosionsbereich liegt zwischen 5,2 Vol.‑% als untere Explosionsgrenze (UEG) und 61,2 Vol.‑% als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 250 °C.[1] Der Stoff fällt somit in die Temperaturklasse T3. Bei Kontakt mit Wasser erfolgt eine heftige Zersetzung.[1]
Chemische Eigenschaften
Durch die Umsetzung mit Alkylhalogeniden können in einer Arbuzov-Reaktion die entsprechenden Phosphonsäureester erhalten werden.[6]
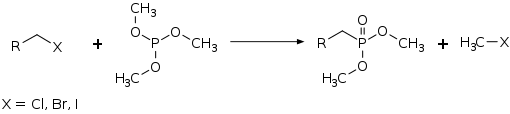
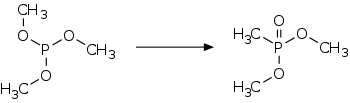
Dieser Reaktionstyp kann thermisch oder katalytisch initiiert als Isomerisierung zum Dimethylmethylphosphonat führen. Diese Reaktion verläuft mit einer Reaktionswärme von −180,7 kJ·mol−1 bzw. −1456 kJ·kg−1 stark exotherm, die unkontrolliert explosionsartig verlaufen kann.[7][8][9] Bei einem Störfall am 1. Dezember 2014 bei der Schill & Seilacher Chemie GmbH in Pirna kam es zum Durchgehen von 5 Tonnen Trimethylphosphit, wobei ein Todesfall und vier Verletzte sowie ein Sachschaden von einigen Millionen Euro zu verzeichnen waren.[10]
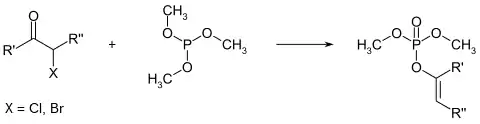
In einer Perkow-Reaktion ergeben sich mit α–Halogenketonen organische Vinylphosphate.[6]
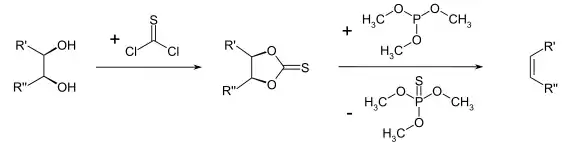
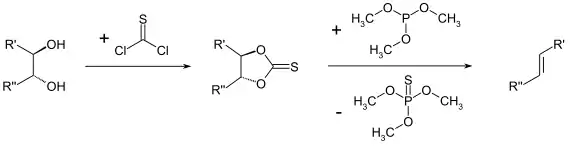
Aus 1,2-Diolen können nach Corey-Winter in einer zweistufigen Synthese nach Umsetzung mit Thiophosgen zum Thiocarbonat und anschließender Reduktion mit Trimethylphosphit die entsprechenden Alkene erhalten werden. Dabei verläuft der Abbauschritt der Thiocarbonatzwischenstufe stereoselektiv. So resultieren mit guter Ausbeute aus den cis-1,2-Diolen die cis-Alkene bzw. aus trans-1,2-Diolen die trans-Alkene.[6]
Oberhalb von 200 °C erfolgt die thermische Zersetzung unter Bildung von Phosphorwasserstoff, Methanol, phosphoriger Säure und anderer Phosphorverbindungen.[11] Die Verbindung reagiert heftig und mit starker Wärmeentwicklung mit Wasser und Säuren. Bei der Hydrolyse wird leichtentzündliches Methanol gebildet.[11] Der Kontakt mit Magnesiumperchlorat (z. B. als Trockenmittel) führt zur Bildung von explosivem Methylperchlorat.[11]
Verwendung
Die Verbindung wird als Methylierungs- und Phosphorylierungsmittel vor allem bei der Synthese von Insektiziden und Herbiziden. verwendet.[4]
Einzelnachweise
- Eintrag zu Trimethylphosphit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-510.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 121-45-9 bzw. Trimethylphosphit), abgerufen am 2. November 2015.
- Eintrag zu Trimethylphosphit. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. August 2012.
- Dutt, N.V.K.; Kahol, A.P.; Jyothiraju, P.: Vapor Pressure of Trimethyl Phosphite and Triethylamine in J. Chem. Eng. Data 27 (1982) 389–370, doi:10.1021/je00030a001. Anpassung der Messdaten nach Antoine durch Bearbeiter
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Trimethyl phosphite, abgerufen am 8. August 2013.
- Regenass, W.: Thermoanalytische Methoden in der chemischen Verfahrensentwicklung in Thermochim. Acta 20 (1977) 65–79, doi:10.1016/0040-6031(77)85041-7.
- Regenass, W.: Calorimetric Monitoring of Industrial Chemical Processes in Thermochim. Acta 95 (1985) 351–368, doi:10.1016/0040-6031(85)85296-5.
- IChemE Symposium series no. 102: Pressure Hazards - Hazards from Pressure: Exothermic Reactions, Unstable Substances, Pressure Relief and Accidental Discharge, 1987, S102-21, Bourne, J.R.; Brogli, F.; Hoch, F.; Regenass, W.: Heat transfer from exothermically reacting fluid in vertical unstirred vessels.
- Umweltbundesamt - Zentrale Melde- und Auswertestelle für Störfälle und Störungen in verfahrenstechnischen Anlagen (ZEMA), Jahresbericht 2012–2014, Seiten 223-225, pdf
- Roth/Weller: Gefährliche Chemische Reaktionen, ecomed SICHERHEIT, Verlagsgruppe Hüthig Jehle Rehm GmbH, Ausgabe 08/2011.


