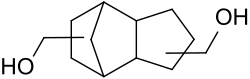
Tricyclodecandimethanol
Tricyclodecandimethanol ist das bei der Hydroformylierung von Dicyclopentadien und anschließender Hydrierung entstehende Isomerengemisch aus primären Diolen mit dem Grundgerüst eines Tetrahydrodicyclopentadiens. Aufgrund seiner interessanten fluiddynamischen und optischen Eigenschaften eignet sich TCD-DM als Diolkomponente in Polyestern und Polyurethanen und als Molekülbaustein für (Meth)acrylatmonomere.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Isomerengemisch | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tricyclodecandimethanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H20O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, viskose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196,29 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
< 1 hPa bei 20 °C | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (11 g·l bei 20 °C)[1] und mischbar mit polaren organischen Lösungsmitteln[2] | ||||||||||||||||||
| Brechungsindex |
1,520 (50 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Als nichtkonjugiertes Dien lässt sich Dicyclopentadien DCPD durch die von Otto Roelen entwickelte Oxosynthese[4] mit Kohlenmonoxid und Wasserstoff unter homogener Katalyse mit Rhodium in aromatischen Lösungsmitteln stufenweise zum Monoaldehyd und weiter zum Dialdehyd hydroformylieren.[5]

Dabei treten intermediär gebildete Rhodiumhydridocarbonyle mit den isolierten Doppelbindungen im starren Dicyclopentadien-Gerüst von der Ober- und Unterseite des Ringsystems in Wechselwirkung und Kohlenmonoxid wird in die entstandene Rhodium-Alkylbindung eingeschoben. Wasserstoff verdrängt dann den gebildeten Acylkomplex unter Regenerierung des Rhodiumhydridocarbonyls und Bildung von TCD-dicarbaldehyd.
Die direkte Hydrierung ohne Abtrennung des homogen gelösten Rhodiumkatalysators und ohne vorherige Isolierung des thermolabilen Dialdehyds erfolgt an heterogenen Nickel-Festbettkatalysatoren, wobei die Zugabe geringer Wassermengen zu wesentlich höheren Ausbeuten (ca. 80 %, bezogen auf DCPD) führt.[6]

Die Abtrennung und Reinigung des Produkts erfolgt durch Vakuumdestillation.
Isomerie
Das tricyclische Diol Tricyclodecandimethanol ist – wie sein Präkursor Tricyclodecandicarbaldehyd – ein Gemisch aus insgesamt 32 möglichen Isomeren, die durch die regio- und stereochemisch unselektive Hydroformylierung des Dicyclopentadiens entstehen, das seinerseits ein Gemisch aus exo- und endo-Isomer darstellt.[2] Den vier regioselektiven Isomeren (I – IV) können jeweils acht (4 × 2) Stereoisomere zugeordnet werden – der Angriff erfolgt von oberhalb der Molekülhauptebene (blaue Pfeile) und/oder von unten (grüne Pfeile).[7]

Eigenschaften
Die Verbindung ist eine farblose Flüssigkeit mit mildem Geruch, die sich etwas in Wasser und gut in polaren organischen Lösungsmitteln, wie z. B. Alkoholen, löst.[2]
Längere Lagerung bei Temperaturen um den Stockpunkt von 18 °C erzeugt Trübungen durch kristallisierende Isomere. Dank der starren und kompakten Molekülstruktur der verbrückten cycloaliphatischen TCD-Diolisomeren besitzen die daraus gebildeten Derivate eine Reihe besonderer mechanischer und optischer Eigenschaften.
Der Brechungsindex von TCD-DM ist für eine nicht-aromatische und halogenfreie Flüssigkeit sehr hoch und die Viskosität beträgt bei Raumtemperatur beträchtliche 14·106 mPa·s. Daher empfiehlt sich die Verarbeitung von TCD-Diol bei erhöhter Temperatur oder in Lösung.
Anwendungen
Tricyclodecandimethanol wird wegen seiner mechanischen, z. B. Adhäsion, und optischen Eigenschaften, z. B. UV-Beständigkeit, als Haftvermittler in hochwertigen Klarlacken, z. B. für Autoreparaturlackierungen vorgeschlagen.[8]
Als Diolkomponente verleiht TCD-Diol (ungesättigten) homo- und copolymeren Polyestern, Polyurethanen und Polycarbonaten vorteilhafte Eigenschaften, wie z. B. verbesserte Alterungsbeständigkeit, verringerte Vergilbungstendenz, höhere Wärmefestigkeit, geringe Schrumpfneigung, erhöhte Flexibilität bei hoher Bruchfestigkeit. Polyurethane mit TCD-DM zeigen wegen niedrigerer Glasübergangstemperaturen höhere Flexibilität in der Kälte und deutlich geringere Permeabilität für Wasserdampf.[2]
Der Diester mit Acrylsäure ist wegen seiner relativ niedrigen Viskosität ein auch für den 3D-Druck geeignetes Monomer, das durch UV- oder Elektronenbestrahlung polymerisiert werden kann.
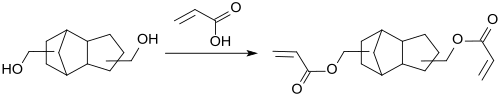
Die resultierenden Polyacrylate werden wegen hoher Vernetzungsgeschwindigkeit, großer Härte, geringer Schrumpfungsneigung und guter Adhäsionseigenschaften als Dentalkunststoffe verwendet. Der hohe Brechungsindex macht das TCD-Dioldiacrylat für optische, z. B. für Brillengläser[9], und für optoelektronische Anwendungen, z. B. für Lichtleitfasern und Beschichtungen interessant.
Literatur
- Boy Cornils: Hydroformylierung (Oxo-Synthese). In: J. Falbe, U. Hasserodt: Katalysatoren, Tenside und Mineralöladditive, Georg Thieme Verlag, 1978, ISBN 3-13-552601-1.
Einzelnachweise
- Eintrag zu Tricyclo[5.2.1.0(2,6)]decandimethanol, Isomerengemisch in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Mai 2020. (JavaScript erforderlich)
- H. Lange, M. Popp, M. Redetzky: Dreimal schneller am Gelpunkt. In: Adhaes Kleb Dicht. Band 60, Nr. 6, 2016, S. 26–31, doi:10.1007/s35145-016-0029-8.
- Sicherheitsdatenblatt: TCD Alkohol DM. Oxea, 4. Juli 2018, abgerufen am 4. Mai 2020.
- Patent DE849548: Verfahren zur Herstellung von sauerstoffhaltigen Verbindungen. Veröffentlicht am 20. September 1938, Anmelder: Chemische Verwertungsgesellschaft Oberhausen m.b.H., Erfinder: O. Roelen.
- Patent DE1618384: Verfahren zur Herstellung von Tricyclodecan-Dimethylolen durch Hydroformylierung von Dicyclopentadien über Rhodium enthaltenden Katalysatoren und anschließende Hydrierung zu den entsprechenden Diolen. Angemeldet am 10. März 1967, veröffentlicht am 16. September 1971, Anmelder: Ruhrchemie AG, Erfinder: J. Falbe.
- Patent EP1604966B1: Verfahren zur Herstellung von Tricyclo-[5.2.1.0 2,6]-decandimethylol. Angemeldet am 31. Mai 2005, veröffentlicht am 16. Januar 2013, Anmelder: OXEA GmbH, Erfinder: W. Dukat, E. Storm, K. Schmid.
- Patent EP1323795A1: Radiation curable compositions for pigmented liquid inks. Angemeldet am 20. Dezember 2001, veröffentlicht am 2. Juli 2003, Anmelder: UCB S.A., Erfinder: F. Bergiers, I. Bhattacharya, L. Lindekens, S. van den Branden.
- Patent EP1163303B1: Die Verwendung von Tricyclodecandimethanol zur Herstellung von Mehrschichtlackierungen. Angemeldet am 21. Februar 2000, veröffentlicht am 16. Juni 2004, Anmelder: BASF Coatings AG, Erfinder: H. Baumgart, H.-P. Rink, U. Röckrath, T. Farwick.
- Patent WO9638486A1: High index/high Abbe number composition. Angemeldet am 24. Mai 1996, veröffentlicht am 5. Dezember 1996, Anmelder: Sola International Holdings Ltd., Erfinder: H.K. Toh, I.R. Bateman, D.R. Diggins, B.G. Cieslinski.
