Thiepan
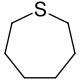
Thiepan, auch Hexamethylensulfid genannt, ist der einfachste schwefelhaltige gesättigte siebengliedrige Heterocyclus.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thiepan | |||||||||||||||
| Andere Namen |
Hexamethylensulfid | |||||||||||||||
| Summenformel | C6H12S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 116,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
173–174 °C[1] | |||||||||||||||
| Brechungsindex |
1,5044 (18 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Die Darstellung von Thiepan kann durch die Reaktion von 1,6-Dibromhexan mit Natriumsulfid[4] oder 1,6-Diiodhexan mit Kaliumsulfid[5] erfolgen.
Eigenschaften
Thiepan siedet bei 173–174 °C und besitzt eine Dichte von 0,99 g/cm3.
Reaktionen
Die möglichen Reaktionen beschränken sich weitgehend auf Reaktionen am Schwefelatom und dessen α-Position, dem Kohlenstoff neben dem Schwefel. So kann Thiepan mit Kaliumpermanganat zu Sulfonen[6] oder mit Wasserstoffperoxid zu Sulfoxiden oxidiert werden.[7]
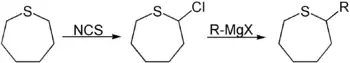
An α-Kohlenstoff können auch Abgangsgruppen eingeführt werden. So liefert die Reaktion mit N-Chlorsuccinimid 2-Chlorthiepan.[8] Dies ermöglicht weitere Reaktionen mit Nukleophilen. Hierzu können beispielsweise Grignard-Reagenzien[9] zur Einführung organischer Reste verwendet werden.
Einzelnachweise
- Mueller in: Monatsh. Chem. 1953, 84, 1206–1214.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-484.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. Singh, A. Mehrotra, S. L. Regen: High Yield Medium Ring Synthesis of Thiacycloalkanes, in: Synth. Commun. 1981, 11, 409–412.
- J. v. Braun: Über cyclische Sulfide, in: Chem. Ber. 1910, 43, 3220–3226.
- G. W. Gokel, H. M. Gerdes, D. M. Dishong in: J. Org. Chem. 1980, 45, 3634–3639.
- R. L. Crumbie, D. D. Ridley in: Aust. J. Chem. 1981, 34, 1027–1035.
- H. J. Gais in: Angew. Chem. 1977, 89, 201–202.
- H. Sashida, T. Tsuchiya in: Heterocycles 1982, 19, 2147–2150.