Arrhenius-Gleichung
Die Arrhenius-Gleichung, benannt nach Svante Arrhenius, beschreibt näherungsweise eine quantitative Temperaturabhängigkeit bei physikalischen und vor allem chemischen Prozessen, bei denen auf molekularer Ebene eine Aktivierungsenergie überwunden werden muss. Sie beschreibt eine phänomenologische Beziehung und gilt für sehr viele chemische Reaktionen. Sie ist mit der Eyring-Gleichung verwandt, die einen Zusammenhang der mikroskopischen Deutung darstellt.
Arrhenius-Gleichung in der chemischen Reaktionskinetik
Die Arrhenius-Gleichung beschreibt in der chemischen Kinetik für den Spezialfall monomolekularer Reaktionen die quantitative Abhängigkeit der Reaktionsgeschwindigkeitskonstanten von der Temperatur:[1][2][3]
mit
- präexponentieller oder Frequenzfaktor, entspricht nach der Stoßtheorie dem Produkt aus der Stoßzahl Z und dem Orientierungsfaktor P:
- Aktivierungsenergie (Einheit: J·mol−1),
- universelle Gaskonstante (8,314 J·K−1·mol−1),
- absolute (thermodynamische) Temperatur (Einheit: K).
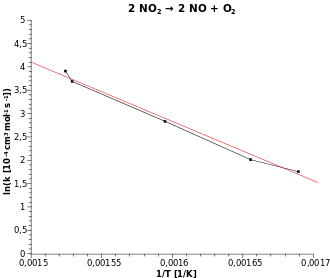
Der Arrheniusgraph ist eine reziproke Darstellung, bei der die logarithmierte Geschwindigkeitskonstante gegen den Kehrwert der Temperatur aufgetragen wird (vgl. Abb.):
Temperaturabhängigkeit des Frequenzfaktors
Die Arrhenius-Gleichung gilt jedoch nicht exakt, weil auch temperaturabhängig ist und häufig der Gesetzmäßigkeit
folgt. Somit nimmt auch der präexponentielle Faktor mit steigender Temperatur in geringem Maß (Wurzelfunktion) zu. Seine Temperaturabhängigkeit ist jedoch deutlich geringer als die des Exponentialterms. In diesem Fall kann eine modifizierte Arrhenius-Gleichung verwendet werden:[4]
Mit dem zur Arrhenius-Zahl zusammengefassten Exponenten
wird die Arrhenius-Gleichung auch folgendermaßen dargestellt:
Arrhenius-Gleichung bei anderen Prozessen
Die Temperaturabhängigkeit der Viskosität von Flüssigkeiten, der Ladungsträgerdichte bei Eigenleitung in Halbleitern sowie der Diffusionskoeffizienten in Feststoffen wird ebenfalls durch eine Arrhenius-Gleichung beschrieben.
Berechnung der Aktivierungsenergie
Durch Messen zweier Geschwindigkeitskonstanten , und zweier Temperaturen derselben Reaktion kann die Aktivierungsenergie durch das Aufstellen der Arrhenius-Gleichung für die beiden Messungen wie folgt berechnet werden (unter der Annahme, dass A nicht von der Temperatur abhängt):
Ziehen des natürlichen Logarithmus und Einführung eines Hauptnenners liefert:
Umstellen nach ergibt schließlich:
Eine Temperaturerhöhung führt zur Zunahme der Reaktionsgeschwindigkeit. Eine Faustregel, die sogenannte Reaktionsgeschwindigkeit-Temperaturregel (RGT-Regel), sagt bei einer Temperaturerhöhung von eine Verdopplung bis Vervierfachung der Reaktionsgeschwindigkeit voraus. Der Faktor, um den sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung von 10 K ändert, wird als Q10-Wert bezeichnet.
Für eine -fach höhere Reaktionsgeschwindigkeit gilt demnach:
und somit:
Siehe auch
Einzelnachweise
- Jacobus Henricus van’t Hoff: Études de dynamique chimique. Frederik Muller & Co., Amsterdam 1884, S. 114–118.
- Svante Arrhenius, Z. Phys. Chem. 1889, 4, S. 226–248.
- Eintrag zu Arrhenius equation. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00446 – Version: 2.3.1.
- Eintrag zu modified Arrhenius equation. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03963 – Version: 2.3.1.
- Charles E. Mortimer, Ulrich Müller, Chemie - Das Basiswissen der Chemie Seite, 11. Auflage, ISBN 978-3-13-484311-8, Seite 266f
- M. Binnewies, Allgemeine und Anorganische Chemie, 1. Auflage 2004. ISBN 3-8274-0208-5, S. 299f.