Albright-Goldman-Oxidation
Die Albright-Goldman-Oxidation ist eine Namensreaktion der organischen Chemie, die erstmals 1965 von den amerikanischen Chemikern J. Donald Albright und Leon Goldman beschrieben wurde.[1] Sie eignet sich insbesondere zur Synthese von Aldehyden aus primären Alkoholen. Analog lassen sich sekundäre Alkohole zu Ketonen oxidieren.[2] Dimethylsulfoxid/Essigsäureanhydrid dient als Oxidationsmittel.[3]
Übersichtsreaktion
Die Albright-Goldman-Oxidation ermöglicht eine milde Oxidation von primären Alkoholen zu Aldehyden. Eine weitere Reaktion zu den entsprechenden Carbonsäuren findet dagegen nicht statt:
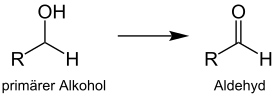
Aus der Oxidation von sekundären Alkoholen gehen auf diese Weise Ketone hervor:

In beiden Reaktionen steht R für einen organischen Rest. Bei der Oxidation des sekundären Alkohols können statt der grün markierten Methylgruppe auch andere Alkyl- oder Arylgruppen vorliegen.
Reaktionsmechanismus
Im Folgenden soll ein möglicher Reaktionsmechanismus für die Albright-Goldman-Oxidation eines primären Alkohols zum korrespondierenden Aldehyd gemäß der ersten Übersichtsreaktion beschrieben werden:[4]

Zunächst reagiert Dimethylsulfoxid 1 mit Essigsäureanhydrid zu einem Sulfonium-Ion. Daraufhin erfolgt die Addition des primären Alkohols. Zusätzlich wird Essigsäure abgespalten, so dass die Zwischenstufe 2 entsteht. Schließlich reagiert diese unter Abspaltung von Essigsäure und Dimethylsulfid zum Aldehyd.
Beispielreaktion
Bei der Albright-Goldman-Oxidation handelt es sich um ein besonders mildes Oxidationsverfahren. Damit eignet es sich zur Oxidation von Verbindungen, wie Indolalkaloiden, die empfindlich gegenüber nichtselektiven Oxidationsmitteln sind. Auch bei sterisch gehinderten Hydroxygruppen kann diese Reaktion eingesetzt werden. Eine beispielhafte Anwendung ist die Oxidation des Indolalkaloids Yohimbin:[5]

Atomökonomie
Zur Oxidation der Alkohole werden bei der Albright-Goldman-Synthese Dimethylsulfoxid und Essigsäureanhydrid in stöchiometrischen Mengen eingesetzt. Als Abfallstoffe fallen Dimethylsulfid und Essigsäure an. Gleichzeitig weist das Produkt der Reaktion (Aldehyd oder Keton) eine geringere Anzahl an Atomen auf als der eingesetzte Alkohol. Demzufolge ist die Atomökonomie dieser Reaktion umso schlechter, je geringer die molare Masse des eingesetzten Alkohols ist.
Siehe auch
Eine alternative Methode zur Oxidation primärer Alkohole zu Aldehyden ist die Swern-Oxidation.
Einzelnachweise
- J. Donald Albright, Leon Goldman: Indole Alkaloids. III.1 Oxidation of Secondary Alcohols to Ketones. In: The Journal of Organic Chemistry. Band 30, Nr. 4, 1965, S. 1107–1110, doi:10.1021/jo01015a038.
- J. Donald. Albright, Leon. Goldman: Dimethyl sulfoxide-acid anhydride mixtures for the oxidation of alcohols. In: Journal of the American Chemical Society. Band 89, Nr. 10, 1. Mai 1967, ISSN 0002-7863, S. 2416–2423, doi:10.1021/ja00986a031.
- Michael Smith: March's advanced organic chemistry : reactions, mechanisms, and structure. Eighth edition Auflage. Hoboken, New Jersey 2020, ISBN 978-1-119-37180-9, S. 1451.
- Zerong Wang: Comprehensive organic name reactions and reagents Volume 1. John Wiley, Hoboken (N.J.) 2009, ISBN 978-0-470-28662-3, S. 33–36.
- J. Donald Albright, Leon Goldman: Dimethyl sulfoxide-acid anhydride mixtures for the oxidation of alcohols. In: Journal of the American Chemical Society. Band 89, Nr. 10, 1967, S. 2416–2423, doi:10.1021/ja00986a031.