Survivin
Survivin, auch als BIRC5 oder API4 bezeichnet, ist ein Apoptose-hemmendes Protein, welches im Wesentlichen nur von Krebszellen produziert wird. Das Tumorantigen[1] wird auch „Überlebens-Protein“ genannt. Daraus leitet sich auch der aus dem Englischen stammende Name – to survive (überleben) – ab.[2]
| Survivin | ||
|---|---|---|
 | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 142 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Isoformen | 7 | |
| Bezeichner | ||
| Gen-Name | BIRC5 | |
| Externe IDs | ||
| Inhibitorklassifikation | ||
| MEROPS | I32.005 | |
Da Survivin im adulten Körper im Wesentlichen nur in Malignomen und nicht im Normalgewebe zu finden ist und es eine große Bedeutung für die Apoptoseregulation in transformierten Zellen aufweist, wurde es schon kurz nach seiner Entdeckung als potenzieller Biomarker für die Diagnostik und Prognose von Krebserkrankungen, sowie als mögliches Target in der Krebstherapie vorgeschlagen.[3][4]
Entdeckung
Survivin wurde erstmals 1997 von G. Ambrosini, C. Adida und D. C. Altieri in verschiedenen malignen Zelllinien und einer Reihe von fetalen Geweben identifiziert.[5][6] Entdeckt wurde es mittels Hybridisierungsscreening einer humanen Genbank mit der cDNA des Faktor-Xa-Rezeptors EPR-1 (effector cell protease receptor-1).[7]
Vorkommen
Während der Embryonalentwicklung hat Survivin die Funktion, die korrekte Weitergabe der Chromosomen in den sich teilenden Zellen zu überwachen. Nach der Embryonalentwicklung ist dieses Protein in ruhenden gesunden Zellen kaum noch vorhanden. Dagegen produzieren die Zellen fast aller Tumoren Survivin, um unkontrolliert zu wachsen und sich gegen Therapien besser schützen zu können.[8]
Eigenschaften
Das für die Expression von Survivin verantwortliche Gen ist 14,7 kb groß und liegt auf dem Chromosom 17q25.[7] Es besteht aus drei Introns und vier Exons.[9] Das Gen kodiert für das Protein, welches aus 142 Aminosäuren besteht und eine molare Masse von 16.390 Da aufweist.[10] Als Klasse-3-IAP (inhibitor of apoptosis) verhindert Survivin die apoptotische Funktion von essenziellen BIR-Domänen (baculovirus IAP repeats).[6][11][12]
Derzeit sind fünf Spleiß-Varianten von Survivin bekannt:
- wt-Survivin (142 Aminosäuren)
- 2B-Survivin (165 Aminosäuren)
- Survivin-Δ3 (137 Aminosäuren)
- 3B-Survivin (2005 entdeckt).[7]
- 2α-Survivin (74 Aminosäuren)
Survivin unterscheidet sich von anderen IAPs durch:
- das Vorhandensein nur einer BIR-Domäne
- das Fehlen einer CARD (caspase recruitment domain)
- das Fehlen einer RING-Domäne (really interesting new gene)
- die geringe molare Masse von 16,5 kDa.[13]
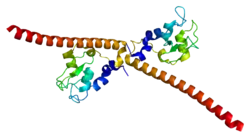
Das Survivin-Protein ist ein bow-tieshaped-Dimer. Ein Survivin-Monomer besteht aus einer BIR-Domäne, die drei α-Helices und einem dreisträngigen β-Faltblatt. Größtenteils wird die Form der Domäne durch einen Zink-Finger (mit vier Zink-Liganden) stabilisiert. Die Dimer-Formation wird durch Wasserstoffbrückenbindungen und van der Waals-Kräfte gebildet.[13][14]
Die Aminosäurensequenz für Survivin (Spezies: Homo sapiens) im Einbuchstabencode ist:[15]
mgaptlppaw qpflkdhris tfknwpfleg cactpermae agfihcpten epdlaqcffc fkelegwepd ddpieehkkh ssgcaflsvk kqfeeltlge flkldrerak nkiaketnnk kkefeetakk vrraieqlaa md
Funktionsmechanismus
Die Mechanismen der anti-apoptotischen Funktion von Survivin sind noch nicht vollständig erforscht. Survivin soll den Mitochondrien-abhängigen, so genannten intrinsischen Apoptoseweg, antagonisieren.[16][17] Die inhibierende Wirkung von Survivin auf die Apoptosekaskade scheint über eine Inaktivierung der Zelltodprotease Caspase-9 vermittelt und von einem Kofaktor (HBXIP) abhängig zu sein.[6][18] Die vollständige Aufklärung des Funktionsmechanismus von Survivin wäre insbesondere für mögliche Therapieansätze bei Krebserkrankungen von großem Interesse.
Diagnostische Anwendungen
Survivin lässt sich bei Harnblasenkarzinomen im Urin nachweisen. Zurzeit laufen hierzu einige klinische Studien.[19][20]
Weitere diagnostische Anwendungen sind in der Entwicklung.[21]
Potenzielle Therapieansätze in der Onkologie
Alle zytotoxischen Chemotherapeutika wirken – wie auch die Strahlentherapie – über die Induktion der Apoptose in malignen Zellen. Die vermehrte Expression von Apoptose-Inhibitoren ist eine Gegenmaßnahme der Krebszellen um deren Überleben zu sichern.[22] Dementsprechend ist die Überexprimierung von Survivin bei Krebszellen mit einer deutlich reduzierten Überlebensrate der betroffenen Patienten,[23][24][25] einer höheren Rezidiv-Wahrscheinlichkeit und einer reduzierten Apoptoserate in Tumorzellen verbunden.[3][26] Survivin ist deshalb ein wichtiges Zielmolekül für die Entwicklung neuer therapeutischer Arzneimittel.[27][28]
Nach seiner Produktion wird das Survivin in das Zytoplasma transportiert, was vermutlich eine wichtige Rolle für die krebsfördernde Funktion von Survivin spielt. Bei einigen Patienten ist dieser Transport allerdings offensichtlich gestört und das Survivin befindet sich vorwiegend im Zellkern. Erste Studien zeigen, dass diese Patienten bessere Überlebenschancen haben.[8]
Dieser Mechanismus ist der Anknüpfungspunkt für neue Krebstherapien, die den Transport von Survivin in das Zytoplasma verhindern sollen. Damit sollen Tumorzellen empfindlicher gegenüber konventionellen Krebstherapien (Chemotherapie und Strahlentherapie) werden.[8][29] Die Firma Lilly hat ein Antisense-Oligonukleotid in der Entwicklung, welches Survivin blockieren soll.[30]
YM155 von Astellase ist ein Survivin-Suppressor, der gezielt die Expression von Survivin unterdrücken soll. Die Verbindung ist ein small molecule mit einem Naphthochinon-Grundkörper und befindet sich in der klinischen Erprobung (Phase II (Stand September 2009), bei nichtkleinzelligem Bronchialkarzinom NSCLC[31] und malignem Melanom).[32][33][34]
Auch krebsimmuntherapeutische Ansätze mit Survivin befinden sich in der Entwicklung.[35] All diesen Konzepten gemein ist, dass sie als Ergänzungstherapie die konventionellen therapeutischen Interventionen (Chemo- und Strahlentherapie) in ihrer Wirksamkeit potenzieren sollen.[28]
Sonstiges
Resveratrol, ein Polyphenol, das beispielsweise in Rotwein vorkommt, ist offensichtlich in der Lage Survivin zu inhibieren.[36]
Literatur
- R. K. Kanwar, C. H. Cheung, J. Y. Chang, J. R. Kanwar: Recent advances in anti-survivin treatments for cancer. In: Current Medicinal Chemistry Band 17, Nummer 15, 2010, S. 1509–1515, PMID 20166933. (Review).
- M. Guha und D. C. Altieri: Survivin as a global target of intrinsic tumor suppression networks. In: Cell Cycle 8, 2009, S. 2708–2710, PMID 19717980 (Review).
- D. C. Altieri: New wirings in the survivin networks. In: Oncogene 27, 2008, S. 6276–6284, PMID 18931693 (Review), PMC 2683067 (freier Volltext).
- A. C. Mita u. a.: Survivin: key regulator of mitosis and apoptosis and novel target for cancer therapeutics. In: Clin Cancer Res 14, 2008, S. 5000–5005, PMID 18698017, doi:10.1158/1078-0432.CCR-08-0746 (Review).
- H. Yamamoto u. a.: Cancer cells survive with survivin. In: Cancer Sci 99, 2008, S. 1709–1714, PMID 18537980 (Review).
- M. Pennati u. a.: Targeting survivin in cancer therapy. In: Expert Opin Ther Targets 12, 2008, S. 463–476, PMID 18348682 (Review).
- D. C. Altieri: Survivin, versatile modulation of cell division and apoptosis in cancer. In: Oncogene 22, 2003, S. 8581–8589, PMID 14634620 (Review).
- A. G. Uren u. a.: Survivin and the inner centromere protein INCENP show similar cell-cycle localization and gene knockout phenotype. In: Curr Biol 10, 2000, S. 1319–1328, PMID 11084331.
- K. Kobayashi u. a.: Expression of a murine homologue of the inhibitor of apoptosis protein is related to cell proliferation. In: PNAS 96, 1999, S. 1457–1462, PMID 9990045, PMC 15484 (freier Volltext).
- E. C. LaCasse u. a.: The inhibitors of apoptosis (IAPs) and their emerging role in cancer. In: Oncogene 25, 1998, S. 3247–2359, PMID 9916987.
- C. Adida u. a.: Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation. In: Am J Pathol, 152, 1998, S. 43–49, PMID 9422522, PMC 1858132 (freier Volltext).
Weblinks
- Auf dem Weg zu möglicher Krebs-Impfung. 3sat.de; abgerufen am 3. September 2007
- Hoffnung auf Impfung gegen Krebs. orf.at; abgerufen am 3. September 2007
Einzelnachweise
- uni-protokolle.de: Jürgen C. Becker prüft Immuntherapien gegen Krebs. Abgerufen am 3. September 2007
- scinexx: Arrest in der Krebszelle. vom 26. Januar 2008.
- D. C. Altieri: Validating survivin as a cancer therapeutic target. In: Nat. Rev. Cancer 3, 2003, S. 46–54, PMID 12509766.
- A. D. Schimmer: Inhibitor of apoptosis proteins: translating basic knowledge into clinical practice. In: Cancer Res. 64, 2004, S. 7183–7190, PMID 15492230, doi:10.1158/0008-5472.CAN-04-1918.
- G. Ambrosini u. a.: A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. In: Nature Medicine. Bd. 8, 1997, S. 917–921, PMID 9256286.
- S. Weikert: Der Apoptose-Inhibitor Survivin: Ein Tumormarker mit dem Expressionsprofil eines Cancer/Testis-Antigens, 9 Habilitationsschrift, FU Berlin, 2007.
- M. Kappler: Molekulare Charakterisierung des IAP Survivin in Weichteilsarkomen: Bedeutung für Prognose und Etablierung neuer Therapiestrategien. (PDF; 1,4 MB) Dissertation, Universität Halle-Wittenberg, 2005.
- curado.de vom 9. August 2007: Exportstopp gegen Krebswachstum. Abgerufen am 3. September 2007
- F. Li, D. C. Altieri: The cancer antiapoptosis mouse survivin gene: characterization of locus and transcriptional requirements of basal and cell cycle-dependent expression. In: Cancer Res 59, 1999, S. 3143–3151, PMID 10397257.
- UniProt O15392
- N. E. Crook u. a.: An apoptosis-inhibiting baculovirus gene with a zinc fingerlike motif. In: J. Virol. 67, 1993, S. 2168–2174, PMID 8445726, PMC 240327 (freier Volltext).
- R. J. Clem u. a.: Control of programmed cell death by the baculovirus genes p35 and iap. In: Mol. Cell Biol. 14, 1994, S. 5212–5222, PMID 8035800, PMC 359040 (freier Volltext).
- Maureen Müller: Survivin und seine alternativen Spleißvarianten: Untersuchungen zu ihrer Bedeutung für eine Zytostatika-induzierte Apoptose und ihren molekularen Interaktionspartnern. (PDF; 1,8 MB) Dissertation, Heinrich-Heine-Universität Düsseldorf, 2004.
- L. Chantalat u. a.: Crystal structure of human survivin reveals a bow tie-shaped dimer with two unusual alpha-helical extensions. In: Mol Cell 6, 2000, S. 183–189, PMID 10949039.
- apoptosis inhibitor survivin (Homo sapiens). NCBI Protein; abgerufen am 3. März 2010
- D. Grossman u. a.: Transgenic expression of survivin in keratinocytes counteracts UVB-induced apoptosis and cooperates with loss of p53. In: J. Clin. Invest. 108, 2001 S. 991–999, PMID 11581300, PMC 200956 (freier Volltext).
- E. M. Conway u. a.: Deficiency of survivin in transgenic mice exacerbates Fas-induced apoptosis via mitochondrial pathways. In: Gastroenterology. 123, 2002, S. 619–631, PMID 12145814.
- H. Marusawa u. a.: HBXIP functions as a cofactor of survivin in apoptosis suppression. In: Embo J. 22, 2003, S. 2729–2740, PMID 12773388, PMC 156760 (freier Volltext).
- Focus Onkologie: Krebsverdacht bei Survivin im Urin. (Memento vom 28. September 2007 im Internet Archive) (PDF) 9, 2004, S. 31.
- S. F. Shariat u. a.: Urine detection of survivin is a sensitive marker for the noninvasive diagnosis of bladder cancer. In: J Urol 171, 2004, S. 626–630, PMID 14713774.
- R. Löser: Über den Einfluss der Survivin-Expression auf die Überlebenszeit von Patienten mit Prostataneoplasma, die radikal prostatektomiert wurden . (PDF; 888 kB) Dissertation, Universität Hamburg, 2011.
- D. B. Longley, P. G. Johnston: Molecular mechanisms of drug resistance. In: J Pathol 205, 2005, S. 275–292, PMID 15641020.
- H. S. Swana u. a.: Tumor content of the antiapoptosis molecule survivin and recurrence of bladder cancer. In: NEJM 341, 1999, S. 452–453, PMID 10438269, doi:10.1056/NEJM199908053410614.
- A. Islam u. a.: High expression of survivin, mapped to 17q25, is significantly associated with poor prognostic factors and promotes cell survival in human neuroblastoma. In: Oncogene 19, 2000, S. 617–623, PMID 10698506, doi:10.1038/sj.onc.1203358.
- H. Kawasaki u. a.: Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer. In: Cancer Res 58, 1998, S. 5071–5074, PMID 9823313
- M. H. Andersen u. a.: The universal character of the tumor-associated antigen survivin. In: Clin Cancer Res 13, 2007, S. 5991–5994, PMID 17947459, doi:10.1158/1078-0432.CCR-07-0686 (Review).
- swisscancer.ch:Survivin als Zielmolekül zur Förderung der Empfindlichkeit von Tumoren gegenüber Chemotherapie und Signaltransduktion via Death Receptor. Abgerufen am 3. September 2007.
- B. M. Ryan u. a.: Survivin: a new target for anti-cancer therapy. In: Cancer Treat Rev 35, 2009, S. 553–562, PMID 19559538 (Review).
- Neue Perspektiven bei Krebs. (PDF) Lilly Onkologie-Forschung
- S. Heinzel: Zielgerichtete Therapie noch nicht am Ziel. (Memento vom 30. September 2007 im Internet Archive) In: MMP, 27, 2004 S. 109.
- G. Giaccone u. a.: Multicenter phase II trial of YM155, a small-molecule suppressor of survivin, in patients with advanced, refractory, non-small-cell lung cancer. In: J Clin Oncol 27, 2009, S. 4481–4486, PMID 19687333.
- K. D. Lewis, W. Samlowski u. a.: A multi-center phase II evaluation of the small molecule survivin suppressor YM155 in patients with unresectable stage III or IV melanoma. In: Investigational new drugs. Band 29, Nummer 1, Februar 2011, S. 161–166, doi:10.1007/s10637-009-9333-6, PMID 19830389.
- Y. Wang u. a.: YM-155. In: Drugs of the Future 32, 2007, S. 879–882, doi:10.1358/dof.2007.032.10.1145702.
- T. Nakahara u. a.: YM155, a Novel Small-Molecule Survivin Suppressant, Induces Regression of Established Human Hormone-Refractory Prostate Tumor Xenografts. In: Cancer Research 67, 2007, S. 8014–8021; doi:10.1158/0008-5472.CAN-07-1343, PMID 17804712.
- M. H. Andersen u. a.: Cancer treatment: the combination of vaccination with other therapies. In: Cancer Immunol Immunother 57, 2008, S. 1735–1743, PMID 18286284 (Review), PMC 2522294 (freier Volltext).
- T. Hayashibara u. a.: Resveratrol induces downregulation in survivin expression and apoptosis in HTLV-1-infected cell lines: A prospective agent for adult T cell leukemia chemotherapy. In: Nutrition and Cancer, 44, 2002, S. 192–201, PMID 12734068, doi:10.1207/S15327914NC4402_12.