Phospholipase A2
Phospholipase A2 (korrekt: Phosphatidylcholin-2-acylhydrase, kurz PLA2) heißen Enzyme, die Fettsäuren vom C2-Atom von Phosphoglyceriden abspalten. Sie sind damit unverzichtbar für Eukaryoten beim Abbau dieser Stoffe, aber auch als Anfangsreaktion bei der Biosynthese der Prostaglandine. Außerdem enthalten die Gifte der Schlangen, Waranartigen, Insekten, Dornenkronenseesterne und mancher Weichtiere diese Enzyme. Säugetiere besitzen mindestens vier PLA2-Typen, der Mensch hat 16 Isoformen. Mutationen im PLA2G6-Gen können zur seltenen erblichen Neurodegeneration mit Eisenablagerung im Gehirn und zum Karak-Syndrom führen.[1][2]
| Phospholipase A2 | ||
|---|---|---|
| Masse/Länge Primärstruktur | ca. 120 Aminosäuren | |
| Kofaktor | Calcium | |
| Bezeichner | ||
| Gen-Name(n) | PLA2G1B, PLA2G2A, PLA2G2D, PLA2G2E, PLA2G2F, PLA2G3, PLA2G4A, PLA2G4B, PLA2G4C, PLA2G4D, PLA2G4E, PLA2G4F, PLA2G5, PLA2G6, PLA2G10, PLA2G12A | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.1.1.4, Phospholipase | |
| Reaktionsart | Hydrolyse | |
| Substrat | Phosphatidylcholine + H2O | |
| Produkte | 1-Acylglycerolphosphocholin + Carboxylat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten, Proteobakterien | |
Klassifikation
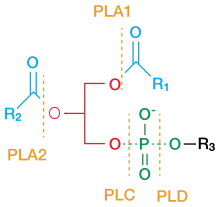
Die Einteilung der PLA2 erfolgt nach Lokalisierung in sezernierte und zytosolische Phospholipasen A2.
Die sezernierten PLA2 sind überwiegend in Amnioten zu finden, 19 sind von Gliederfüßern bekannt und zwei von Cnidarien. Nahezu alle bekannten PLA2 von Reptilien kommen in Nattern- und Vipernartigen vor, drei in Krustenechsen. Alle PLA2 von Reptilien und Gliederfüßern werden von der Giftdrüse sezerniert und wirken als Toxin und Allergen. Die Ausschüttung von PLA2 in höheren Säugetieren ins Blutplasma kann aus mehreren Gründen erfolgen, der wichtigste ist Signaltransduktion bei der Entzündungsreaktion. Manche Isoformen können nach Sekretion in der Zellmembran lokalisiert sein.
Die zytosolischen PLA2 wurden bisher nur in Vierfüßern und im Zebrabärbling gefunden, weiterhin in Pflanzen und Proteobakterien.
Beim Menschen können verschiedene Isoformen der PLA2 nicht nur in verschiedenen Zelltypen lokalisiert, sondern auch für unterschiedliche Substrate spezifisch sein. Menschliche PLA2 sind:
- sezerniert: PLA2G1B, PLA2G2A, PLA2G2D, PLA2G2E, PLA2G2F, PLA2G3, PLA2G5, PLA2G10, PLA2G12A
- zytosolisch: PLA2G4A, PLA2G4B, PLA2G4C, PLA2G4D, PLA2G4E, PLA2G4F, PLA2G6, PLA2G12A
Katalysierte Reaktion
Das Enzym aus der Familie der Esterasen katalysiert die hydrolytische Spaltung von Phospholipiden am zweiten Kohlenstoff-Atom (β-C-Atom). Dabei kommt es u. a. zur Freisetzung von Arachidonsäure aus Membranlipiden.
Die Phospholipase A2 kann durch Glukokortikoide gehemmt werden, was die Synthese von Eikosanoiden einschränkt und damit entzündungshemmend (anti-inflammatorisch) wirkt.
Bedeutung für das Auftreten einer koronaren Herzkrankheit
In einer im Mai 2010 veröffentlichten Studie untersuchten die Autoren an 79 036 Patienten, inwieweit der Phosholipase-A2-Spiegel mit dem Risiko des Auftretens einer koronaren Herzkrankheit, eines Schlaganfalls oder Todesfalls verknüpft war. Dabei zeigte sich ein eindeutiger Zusammenhang, der erhöhte Phosholipase-A2-Werte im Blut gleichauf mit den Risikowerten von Bluthochdruck oder hohem LDL-Cholesterin-Spiegel im Blut stellte.[3][4]
Siehe auch
- Schlangengift
- Bienengift
- Phospholipase
- Phospholipase A1
- Phospholipase C
- Phospholipase D
Einzelnachweise
- UniProt O60733
- Suchergebnis bei UniProt, nach Taxon sortiert
- Koronare Herzkrankheit: Entzündungsmarker ebenso verantwortlich wie Bluthochdruck und LDL-Cholesterin. Meldung in The Lancet vom 30. April 2010.
- The Lp-PLA2 Studies Collaboration. Lipoprotein-associated phospholipase A2 and risk of coronary disease, stroke, and mortality: collaborative analysis of 32 prospective studies. Lancet 2010; 375: 1536. doi:10.1016/S0140-6736(10)60319-4.